近年来,肿瘤免疫疗法已成为继手术、放疗和化疗之后的第四种肿瘤治疗手段,主要包括免疫疫苗,免疫检查点抑制剂治疗,细胞因子治疗及过继性免疫细胞治疗。过继性免疫细胞疗法(adoptive cell therapy,ACT)是通过采集人体自身免疫细胞,经过体外培养扩增及改造使其靶向性及杀伤功能增强,后回输到患者体内实现治疗效果。目前,基于ACT策略的细胞疗法主要包括肿瘤浸润淋巴细胞(TIL),T细胞受体嵌合T细胞(TCR-T)和嵌合抗原受体T细胞(CAR-T)等。由于具有疗效好、毒副作用低、耐药性低等显著优势,免疫细胞治疗技术已成为继传统的手术疗法、化疗和放疗后最具前景的研究方向之一。
截至2021年5月,全球已有近1300多项关于CAR-T的临床试验证明了CAR-T细胞疗法在癌症治疗特别是血液肿瘤治疗中的巨大优势,然而其对实体瘤的治疗效果却十分有限。不同于血液瘤,实体瘤能够构建具有免疫抑制特性的肿瘤微环境(tumor microenvironment, TME),从而影响CAR-T疗法的功效。TME免疫抑制性改变会阻止免疫细胞向病灶的运输及T淋巴细胞对肿瘤的浸润,少数能够浸润实体瘤的T细胞免疫反应仍可能受到微环境中免疫抑制细胞或抑制因子的限制。此外,实体瘤的高度异质性也限制了靶向单一抗原的CAR-T疗法的疗效。

图 1. CAR-M细胞靶向吞噬癌细胞和激活T细胞介导的适应性免疫应答过程
基于CAR-T细胞疗法在临床应用中的优势,研究人员尝试并成功改造其他工程化CAR免疫细胞,试图克服CAR-T治疗的局限性,为实体瘤治疗提供新的方向。其中,CAR修饰的巨噬细胞(CAR-M)被认为是一种有前途的细胞类型。巨噬细胞主要通过吞噬体液和组织中的细胞残片及病原体并呈递抗原以激活淋巴或其他免疫细胞,令其对病原体做出反应。在肿瘤微环境中,巨噬细胞是具有最高浸润率的先天免疫细胞并可与TME中几乎所有细胞成分相互作用,刺激血管生成,增加肿瘤浸润,并介导免疫抑制(1)。
肿瘤相关巨噬细胞(tumor-associated macrophage, TAM)同时具有肿瘤杀伤作用及促肿瘤作用。M1 型巨噬细胞被TLR或Th1细胞因子激活,具有很高的抗原呈递能力的同时,还分泌活性氧(ROS)及促炎性细胞因子,与癌症良好预后相关。相反,M2样巨噬细胞被Th2衍生的细胞因子极化,促进组织修复。同时,M2样巨噬细胞可通过分泌肾上腺髓质素和血管上皮生长因子(VEGF)支持血管生成并表达免疫抑制分子,从而促进肿瘤生长(4) (图2)。
不同于T细胞,巨噬细胞是身体对病毒感染的第一反应者,因此被认为是细胞治疗的重要方向。然而,由于巨噬细胞不易被基因疗法和细胞疗法中使用的标准病毒载体转染,导致通过基因改造细胞攻击癌症的尝试止步不前。2021年3月18日,美国Carisma Therapeutics公司(以下简称为Carisma),宣布完成首例靶向Her2的CAR-M 疗法(CT-0508)受试者给药,标志着CAR-M改造治疗实体瘤进入新纪元(6)(相关科研进展免费下载)。
Carisma研发团队通过基因工程技术改造CAR-M细胞,使其表达靶向Her2抗原的嵌合抗原受体的同时被激活分化成为促炎症的M1型巨噬细胞。因此,改造后的CAR-M细胞不仅能够靶向吞噬肿瘤细胞,还可以通过分泌促炎症细胞因子,改变肿瘤附近的微环境,同时将肿瘤抗原呈现给T细胞,激活T细胞对肿瘤的免疫应答。
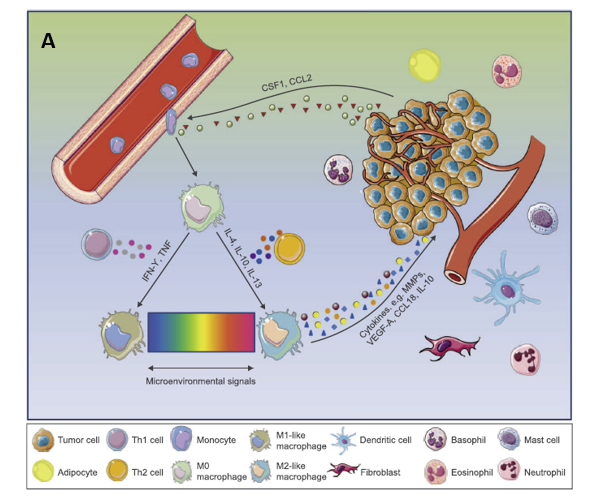
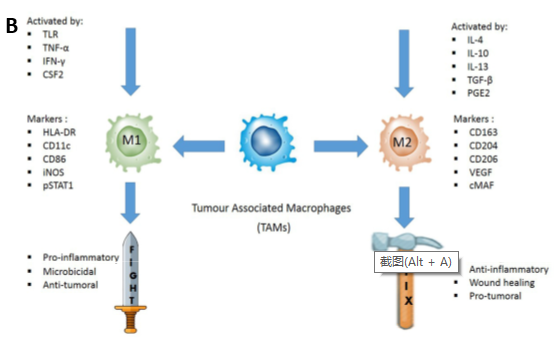
图2. A:肿瘤微环境(乳腺癌)促进肿瘤相关巨噬细胞表现型分化;B:促进(TAM)M1和M2表现型分化的相关因子与BIOMARKER(4, 5)
Carisma临床前研究结果表明,CAR-M疗法有可能克服T细胞疗法在实体瘤治疗中遇到的挑战。在体外实验中,CAR-M细胞表现出抗原特异性吞噬作用和肿瘤清除效果,且不仅对Her2阳性肿瘤有效,对Her2阴性的肿瘤也有一定的杀伤作用,功能上类似原位肿瘤疫苗。在实体瘤异种移植小鼠模型中,单次输注人CAR-M可明显减少肿瘤负担并延长总体生存期(图 3)。在人源化小鼠模型实验中CAR-M可诱导促炎性肿瘤微环境产生并增强抗肿瘤T细胞活性,在存在免疫抑制细胞的情况下,依然能够导致肿瘤的消退。对细胞活性表征结果的进一步分析表明,CAR-M可表达促炎性细胞因子和趋化因子,将M2型巨噬细胞转化为M1型,上调抗原呈递机制,募集抗原并将其呈递给T细胞,同时抵抗免疫抑制细胞因子的作用(5)。
在CAR-M特异性胞吞(phagocytosis)实验体外验证实验过程中,Carisma团队使用了ACROBiosystems生物素化靶点蛋白完成实验,其实验结果与细胞验证结果一致(图4&5)(5)。
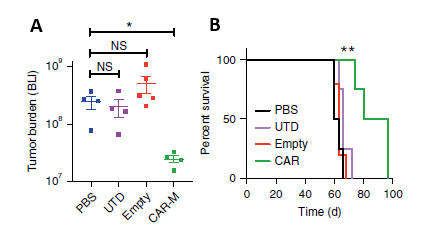
图 3. A: CAR-M treated mice demonstrated a marked reduction in tumor burden; B: CAR-Ms conferred a prolongation of overall survival.
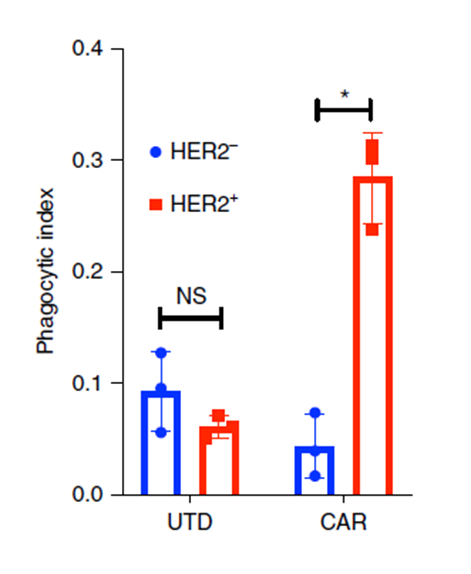
图4. Incucyte-based phagocytosis of HER2 functionalized or control pH-Rodo-labeled beads by UTD or CAR-M.

图 5. FACS-based phagocytosis of HER2− (MDA-468) or HER2+ (SKOV3) target tumor cells by UTD or CAR-M.
综上,尽管CAR-M疗法尚处于 “婴儿期”, 想要真正进入临床仍需突破诸多技术要点,但其展示出得对于解决实体瘤治疗难题的显著优势不容小觑,为免疫治疗提供了新的关键性突破。
ACROBiosystems开发了多种实体瘤相关的生物素化靶点蛋白及相关细胞因子蛋白,纯度及生物活性经MALS/ELISA/SPR/BLI等多技术平台验证,不仅可以用于巨噬细胞相关的抗体的ADCP (antibody-dependent cellular phagocytosis)效应验证,还可以用于 CAR-M体外临床验证及刺激巨噬细胞M1/M2表现型极化,助力CAR-M 细胞疗法开发,帮助您缩短研发周期。
点击图表中分子或产品内容可查看详细信息
|
分子
|
货号
|
产品描述
|
|
Her2
|
HE2-H82E2
|
Biotinylated Human Her2 / ErbB2 Protein, His,Avitag™
|
|
HE2-C82E3
|
Biotinylated Cynomolgus Her2 / ErbB2 Protein, His,Avitag™ (MALS verified)
|
|
PSMA
|
PSA-H82Qb
|
Biotinylated Human PSMA / FOLH1 Protein, His,Avitag™ (active enzyme)
|
|
Mesothelin
|
MSN-H82F6
|
Biotinylated Human Mesothelin / MSLN (296-580) Protein, Fc,Avitag™
|
|
MSN-H82E9
|
Biotinylated Human Mesothelin / MSLN (296-580) Protein, His,Avitag™ (MALS verified)
|
|
CD19
|
CD9-H82E9
|
Biotinylated Human CD19 (20-291) Protein, His,Avitag™ (SPR verified)
|
|
CD9-H82F7
|
Biotinylated Human CD19 (20-291) Protein, Fc,Avitag™
|
|
EGF R
|
EGR-H82E3
|
Biotinylated Human EGF R Protein, His,Avitag™ (MALS verified)
|
|
EGFRvIII
|
EGR-H82E0
|
Biotinylated Human EGFRvIII Protein, Avitag™,His Tag (MALS verified)
|
点击图表中分子或产品内容可查看详细信息
活性(Bioactivity)-ELISA
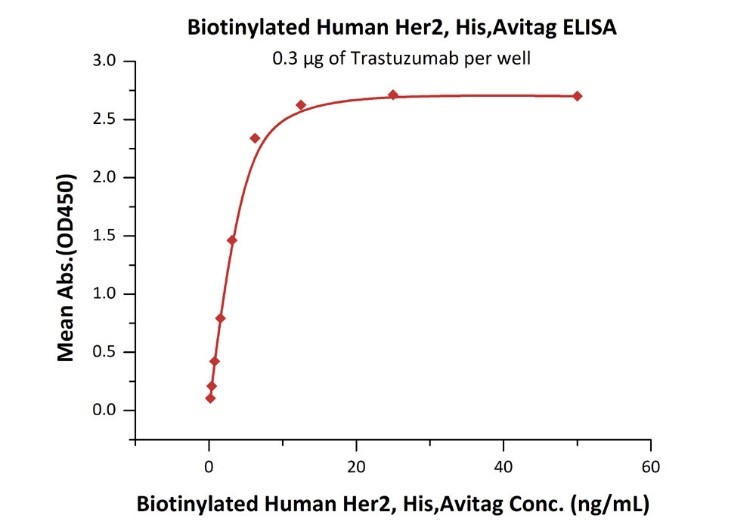
Immobilized Trastuzumab at 3 μg/mL (100 μL/well) can bind Biotinylated Human Her2, His,Avitag (Cat. No. HE2-H82E2) with a linear range of 0.2-6 ng/mL (QC tested).
活性(Bioactivity)-FACS
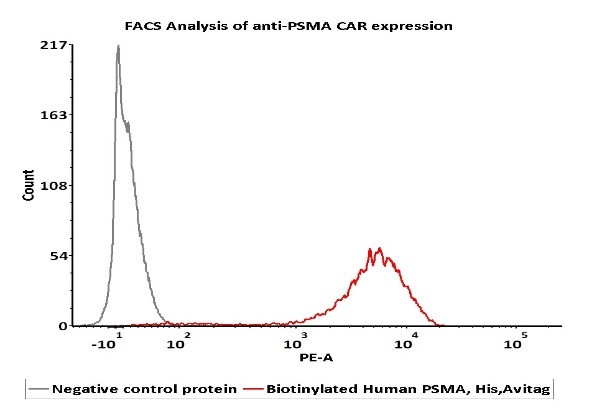
2e5 of PSMA-CAR-293 cells transfected with anti-PSMA-scFv were stained with 100μl of 1μg/mL of Biotinylated Human PSMA, His,Avitag (Cat. No. PSA-H82Qb) and negative control protein respectively, washed and then followed by PE-SA and analyzed with FACS (Routiney tested).
快来下载免费资料包,
了解更多CAR-M最新科研进展详细信息~
您可通过以下方式联系到ACROBiosystems:
邮件:inquiry@acrobiosystems.com
电话:15117918562
微信:扫描下方二维码即可进行沟通

(请备注公司+姓名)
参考文献:
1. Chen Y, Yu Z,Tan X, Jiang H, Xu Z, Fang Y, et al. CAR-macrophage: A newimmunotherapy candidate against solid tumors. Biomed Pharmacother.2021;139:111605.
2. Mangal JL, Handlos JL,Esrafili A, Inamdar S, McMillian S, Wankhede M, et al. Engineering Metabolismof Chimeric Antigen Receptor (CAR) Cells for Developing EfficientImmunotherapies. Cancers (Basel). 2021;13(5).
3. Morrissey MA, WilliamsonAP, Steinbach AM, Roberts EW, Kern N, Headley MB, et al. Chimeric antigenreceptors that trigger phagocytosis. Elife. 2018;7.
4. Jayasingam SD, CitartanM, Thang TH, Mat Zin AA, Ang KC, Ch'ng ES. Evaluating the Polarization ofTumor-Associated Macrophages Into M1 and M2 Phenotypes in Human Cancer Tissue:Technicalities and Challenges in Routine Clinical Practice. Front Oncol.2019;9:1512.
5. Klichinsky M, Ruella M,Shestova O, Lu XM, Best A, Zeeman M, et al. Human chimeric antigen receptormacrophages for cancer immunotherapy. Nat Biotechnol. 2020;38(8):947-53.
6. http://www.globecancer.com/azzx/show.php?itemid=12109




















 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!

































 膜杰作
膜杰作 Star Staining
Star Staining

















