百普赛斯集团ACROBiosystems Group致力于成为全球生物医药、健康产业领域提供关键生物试剂产品及解决方案的行业平台型基石企业,以加速生物医药研发进程为使命。为达成使命,公司践行从“客户出发”的核心价值观,率先从满足客户对产品质量的需求出发,建立严格质量管理体系,帮助客户节约药物研发时间。我们质量管理最根本的关注点,就是要满足并致力于超过客户的期望。
百普赛斯集团ACROBiosystems Group已按照ISO 9001:2015及ISO 13485:2016等国际标准建立了严格的质量管理体系,并获得了相关的认证证书。通过体系有效运行,确保产品和服务的质量得到有效的保证,这是公司的一项战略性决策。公司采用过程方法,对重组蛋白、抗体、酶、细胞因子和试剂盒等产品的全过程进行了系统的规范,并按职能性质构建清晰的组织架构和部门,从而明确了岗位职责、权限及其相互作用。以此确保公司质量方针、质量目标能按照预期制定的实施并实现。
公司通过采用PDCA循环以及基于风险的思维,主动应对市场竞争,在理解利益相关方的需求和期望的基础上,努力提高公司整体效益,旨在增强顾客满意度。
百普赛斯集团ACROBiosystems Group本着“以法律法规为基础,以客户为关注焦点,在未来2-3年内成为靶点药物相关领域重要合作伙伴”的质量方针。愿与客户和供应商诚挚合作,共同进步,和谐发展。在质量控制方面,从生产原液到产成品,质量严格把关,使用多达20+项先进检测技术,历经30+次检测,4次审核,3次放行的全面质检流程,确保产品质量稳定可靠,满足药物开发等严苛要求。
公司于2022年初隆重推出了GMP级相关产品,包括细胞因子、抗体、酶、磁珠等,此类产品不仅生产于药品级的生产厂房,而且参考国内外相关CGT法规设计和控制,从物料系统、生产系统、设施/设备系统、包装/标签系统、实验室控制系统等五大系统作出了控制,全面诠释了 “真正的GMP” 。
点击了解GMP管理体系
守法意识
• 以遵守相关国家或地区的法律法规为基础和前提
客户为关注焦点
• 社会意识:我们组织的宗旨及存在的社会价值来自于客户是否认可和满意我们的工作
• 服务意识:能够从外部和内部客户的需求和关切出发,来指导日常工作和为客户提供服务和创造价值
• 市场意识:开展工作或进行决策时,能够首先从客户的接收、使用习惯为出发点来设计产品、服务流程和进行其他活动
行业重要合作伙伴
• 良好的利润和现金流
• 高效的运营效率与产出
• 良好的品牌知名度和客户关系
• 强大的内部团队支持
• 领先的市场主导地位
ACROBiosystems百普赛斯质量体系发展历程:不断完善的质量体系加速药物开发和临床申报进程
ACROBiosystems百普赛斯对于客户的核心价值
更特别的产品设计
基于结构分析和应用场景开发 |
 95%的蛋白由HEK293生产,以确保蛋白的天然构象 95%的蛋白由HEK293生产,以确保蛋白的天然构象
 根据客户应用需求定制产品 根据客户应用需求定制产品
 多次跨膜靶点蛋白、新一代荧光定点标记、酶学等六大技术平台,技术有保障 多次跨膜靶点蛋白、新一代荧光定点标记、酶学等六大技术平台,技术有保障
 膜杰作、ActiveMax、GENPower、ViruStop等多领域子品牌,研发更专注 膜杰作、ActiveMax、GENPower、ViruStop等多领域子品牌,研发更专注
|
更好更稳定的质量
高纯度、高活性、高稳定性、更小批间差 |
 严格的质量控制,全流程过程控制 严格的质量控制,全流程过程控制
 分析方法通过方法学验证 分析方法通过方法学验证
 FDA DMF备案重组蛋白产品 FDA DMF备案重组蛋白产品
 ISO9001和ISO13485认证 ISO9001和ISO13485认证
 GMP质量管理体系 GMP质量管理体系
 经CNAS认可的SPR检测服务 经CNAS认可的SPR检测服务
|
更完备的技术帮助
提供专业的技术支持和丰富资源 |
 工作日24小时专业技术支持 工作日24小时专业技术支持
 免费获取经验证的Protocol 免费获取经验证的Protocol
 免费获取丰富的市场资料、培训资源 免费获取丰富的市场资料、培训资源
 便捷跟踪前沿进展和市场动态 便捷跟踪前沿进展和市场动态
 完善的法规支持文档 完善的法规支持文档
 更多合作伙伴资源对接 更多合作伙伴资源对接
|
更快更适当的反应
客户至上 |
 多地库存,全球1-5天到货 多地库存,全球1-5天到货
 实时在线客服、本地化专人售前、售后支持 实时在线客服、本地化专人售前、售后支持
 可根据需求定制服务 可根据需求定制服务
 同批次库存预留机制 同批次库存预留机制
|

医疗器械质量管理体系认证
ISO 13485:2016


百普赛斯集团ACROBiosystems Group成立12年以来一直都在不断地完善质量体系,旨在帮助客户加速药物开发和临床申报进程。公司于2016年首次通过了ISO 9001:2015质量管理体系认证;于2019年通过了ISO 13485: 2016医疗器械质量管理体系认证;又于2021年起建立了GMP级别产品质量管理体系; 2022年SPR检测服务通过了CNAS认可。好的质量管理体系会随着客户要求/法规要求/市场环境等不断持续改进。ACROBiosystems拥有经验丰富的专业的质量管理团队,熟悉全球不同国家地区生物医药相关法规,紧密追随行业趋势,可以根据不同产品类型、不同客户应用场景和不断变化的法规要求而快速建立或改进质量管理体系,进行相应的产品开发和生产,以满足不同客户的要求并使之与法规要求/市场环境等相适应。
ISO质量管理体系
ACROBiosystems百普赛斯文件管理体系:四级“金字塔”结构

ACROBiosystems百普赛斯质量体系:六大特色
ACROBiosystems百普赛斯分别于2016年和2019年按照ISO 9001:2015及ISO 13485: 2016的要求建立质量管理体系并取得认证。通过体系有效运行,确保产品和服务从设计开发-小试检测-正式生产检测-上市销售到客户反馈的全生命周期管理。
ACROBiosystems百普赛斯质量体系基于风险的思维以及设计理念,分别从人(E-Learning在线培训系统) 、机(确认和验证管理体系)、料(物料及供应商分级管理体系)、法(文件四级结构)、 环(QA监控生产环境及生产过程)、测(20+项 检测技术,30+次检测步骤, 4次审核,3次放行)等体系模块着手,分别建立管理要求且每个模块均由QA专人负责。ACRO质量管理体系运行过程中,同时运用多种监视和测量手段(日常检测/供方绩效/客户满意度调查/内审/管理评审/外审等)来实时发现体系运行过程中的问题并持续改进,以保证质量管理体系的有效性、充分性和适宜性。
ACROBiosystems百普赛斯质量体系管理六大特色

GMP质量管理体系——精益求精,只为真正的GMP
药品生产质量管理规范(Good Manufacturing Practice, GMP)是药监局为生产优良药品而制定的关于人员、厂房设施与设备、生产管理质量管理以及文件管理等方面的标准规则。它是一套适用于制药等行业的强制性标准,是药品生产和质量管理的基本准则。适用于药品生产的全过程和原料药生产中影响成品质量的关键工序。它是一种先进的管理系统,广泛应用于药品安全生产过程中。要求药品生产企业拥有良好的生产设备、合理的生产工艺、完善的质量管理和严格的检测制度,确保产品质量符合相关标准,并能及时发现生产过程中存在的问题,加以改善。
GMP在药品生产的全过程中,以科学的方法和有效的措施对各项影响产品质量的因素加以全方位的控制,确保制造出的产品始终如一持续的符合生产质量标准。
GMP是一个防止污染(特别是未知的)、混淆和差错的过程,用来弥补最终产品测试的局限性。
为了更好的支持CGT相关客户,2021年ACROBiosystems百普赛斯针对GMP级别产品建立了GMP质量管理体系。
ACROBiosystems百普赛斯GMP质量管理体系
GMP质量管理体系
 经ISO 9001:2015 和 ISO 13485:2016认证
经ISO 9001:2015 和 ISO 13485:2016认证
 生产厂房具备药品生产许可证
生产厂房具备药品生产许可证
 药品B+A级洁净室和自动灌装设备
药品B+A级洁净室和自动灌装设备
 无菌技术与二级除菌过滤
无菌技术与二级除菌过滤
 无动物源性材料和生产环境
无动物源性材料和生产环境
 人员培训体系
人员培训体系
 供应商和原材料管理体系
供应商和原材料管理体系
 质量文件/记录经QA审查和批准
质量文件/记录经QA审查和批准
 完整的批生产和检验记录
完整的批生产和检验记录
 设备维护和校准程序
设备维护和校准程序
 分析方法的验证
分析方法的验证
 完整的法规支持文档(RSF)
完整的法规支持文档(RSF)
 点击咨询完整的法规支持文档(RSF)
点击咨询完整的法规支持文档(RSF)

生产资质展示
 供应商应通过ISO质量体系认证,具有健全的质量管理体系。
供应商应通过ISO质量体系认证,具有健全的质量管理体系。
 生产车间等硬件设施严格符合GMP法规要求 (第三方权威机构的审计证明,药品生产许可证,其他资质证明文件等)。
生产车间等硬件设施严格符合GMP法规要求 (第三方权威机构的审计证明,药品生产许可证,其他资质证明文件等)。
 研发和生产技术先进,具备良好的生产工艺和技术水平,和持续生产供应的能力。
研发和生产技术先进,具备良好的生产工艺和技术水平,和持续生产供应的能力。

ISO 9001:2015和ISO 13485:2016双认证
完善的法规支持文档



“好的、结构确定的蛋白产品,能够尽可能降低药物研发的不确定性,降低药物研发的每一步风险。”
RUO级别产品
作为在靶点蛋白开发积累多年开发经验的ACROBiosystems百普赛斯,已经总结出药物开发用靶点蛋白的关键点。药物开发用靶点蛋白的关键点,主要涵盖五个方面的要素:
★ 纯度和均一性
ACROBiosystems百普赛斯常用的纯度检测方法有SDS-PAGE,HPLC,MALS等。
SDS-PAGE(SDS聚丙烯酰胺凝胶电泳方法),属于变性蛋白分析检测技术,多用于检测目标蛋白和杂蛋白的比例和含量,一般较难看出蛋白在溶液中的聚集情况。
HPLC(高效液相色谱)是蛋白在非变性的状态下、测定溶液中蛋白的纯度和分子量。
MALS(多角度激光散射)是一种先进的蛋白质分子量测定技术,用于检测蛋白在非变性的状态下,溶液中蛋白的分子量和聚集状态。MALS常常和HPLC进行联用,成为常规HPLC技术的有力的补充,可以通过激光散射强度直接测定溶液中蛋白的绝对分子量,且分子量测定不依赖于洗脱体积或保留时间,可以真实测定蛋白在非变性状态下的分子量和聚集状态。使用MALS技术进行质量控制,可以有效保证蛋白的正确天然聚集状态和构象,这是常规HPLC技术所不能实现的。
纯度经MALS验证是ACROBiosystems百普赛斯的优势可以确保蛋白的结构正确,蛋白聚集状态可控产品均一性好,批间一致,这也是ELISA、SPR、BLI活性验证结果一致的基础。所以,对于生物药物开发的客户,所用蛋白的聚集状态,批间差异等都是非常关键的。
ACROBiosystems百普赛斯致力于帮助客户降低药物研发的风险,在纯度方面替客户把好关,为客户提供纯度和均一性好、批间一致,更重要的是结构正确的高质量重组蛋白。
点击阅读:火眼金睛的SEC-MALS:准确测定蛋白分子量,确认蛋白聚体状态 
★ 靶点蛋白尽可能地接近天然的构象
因为蛋白结构是功能活性的基础,只有接近天然构象,蛋白才能正确发挥生物学功能。尤其是蛋白天然的聚集存在形式,正确配对二硫键等,这些对于维持蛋白正确结构非常关键,在靶点蛋白开发过程中要重点关注。ACROBiosystems百普赛斯选用HEK293作为宿主细胞的表达系统,由HEK293系统表达的蛋白会得到更充分的修饰,比如糖基化修饰,更接近人体内的天然构象。这是原核表达系统、非人源的真核系统所不能实现的。靶点蛋白作为抗体药开发的关键原料,天然构象、正确结构的高质量靶点蛋白,对于客户免疫获得抗体、筛选功能抗体、临床验证抗体效果等关键应用场景,会显著提高抗体药物开发的成功率,降低药物开发的不确定性。
★ 活性性能经过目标应用场景验证
在靶点蛋白开发过程中会经常遇到同一个蛋白产品在不同应用场景中表现完全不同的情况,因此需要在研发开始前确定研发目标,明确蛋白的目标应用场景。ACROBiosystems百普赛斯蛋白在开发过程中都会把蛋白放在目标应用场景中,尽量模拟客户的应用场景去评估。
点击阅读:SPR & BLI:蛋白结合活性分析平台
★ 生产的能力和产品持续开发的能力
保证蛋白产品可以长期稳定地生产,保持品质稳定,支持生物药物的研发过程和整个生命周期对蛋白的长期需求。ACROBiosystems百普赛斯拥有超200的专业产品研发人员,新产品开发能力得以充分的保障。
GMP级别产品
ACROBiosystems百普赛斯深入解读国内外相关法规要求,针对细胞治疗药物开发中可能遇到的关键试剂相关问题制定了解决方案。

ACROBiosystems百普赛斯根据中外法规以及客户要求总结了细胞治疗使用GMP级别原材料选择的关键点,并以此为来指导产品的开发、生产和质控——您所关心的, 正是我们所关注的。
★ 供应商生产资质
● 供应商应通过ISO质量体系认证,具有健全的质量管理体系。
● 生产车间等硬件设施严格符合GMP法规要求(提供第三方权威机构的审计证明,比如药品生产许可证、知名第三方机构的GMP审计报告,其他资质证明文件等)。
● 研发和生产技术先进,具备良好的生产工艺和技术水平,和持续生产供应的能力。
点击查看ACROBiosystems百普赛斯相关资质
★ 产品质量和性能
● 产品关键质量属性明确,按照药典要求进行全面分析检定和表征:包括鉴别、含量,纯度、生物学活性、水分,工艺相关杂质,潜在污染物等。
● 产品经过实际应用场景充分验证,性能可满足应用要求(如T细胞培养和激活实验)。
● 各分析方法经过系统验证和溯源,准确可靠可重复,能准确的进行产品质量分析检定,以及用于生产批间差长期监控。
● 分析数据完整性符合法规要求。
点击了解ACROBiosystems百普赛斯GMP级别产品
★ 批间一致性,稳定性
● 生产原料,厂房设备,实验室分析检测,产品包装储存等各方面符合GMP质量管理体系和细胞治疗原辅料的法规要求。
● 生产关键参数控制严格,生产工艺稳定可靠。
● 持续进行生产批间差监控和分析,OOS偏差分析和持续改进,确保产品的生产过程稳定性和批间-致性。
● 产品稳定性充分研究,确保运输、保存和使用过程中,性能稳定可靠。
点击了解质控详情
★ 完善的法规支持文档
● 重点关注安全性,包括来源证明、检验报告书(COA) 、委外检测报告和相关资质证明、包装说明书、无TSE/BSE声明、AOF无动物源性声明、DMF文档、RSF法规支持文件等
点击申请RSF文档 


ACROBiosystems百普赛斯产品质量控制流程图

全面质检
完善的稳定性验证
生物制品稳定性是贯穿于整个药品研发、临床、上市及上市后质量研究的重要内容,为药品的生产、工艺、制剂处方、包装材料、贮存、运输条件等方面提供依据。实时稳定性是研究产品稳定性和确定产品有效期最可靠的方法,但是该方法周期长,极大程度的限制了其使用,所以找到一种更快捷有效的方法就显得尤为重要。基于阿伦尼乌斯方程为理论依据的加速稳定性测试方法是公认的策略之一,近年来,越来越多的研究证明了它的适用性和准确性。
ACROBiosystems百普赛斯的产品分别从加速,冻融,实时,模拟运输等4个方面进行稳定性验证。
加速稳定性:
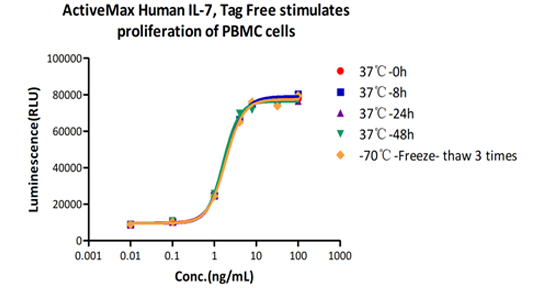
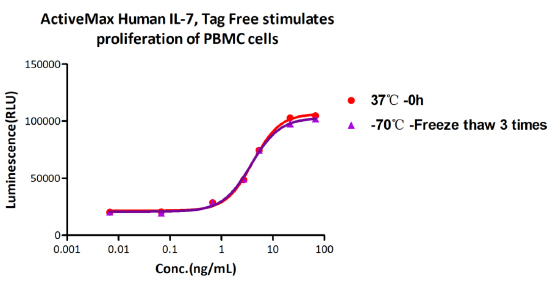
The Cell based assay shows that ActiveMax Human IL-7 (Cat. No. IL7-H4219) is stable at 37°C for 48 hours.
冻融稳定性:
The Cell based assay shows that ActiveMax Human IL-7 (Cat. No. IL7-H4219) is stable at freezing and thawing 3 times.
实时放置稳定性:
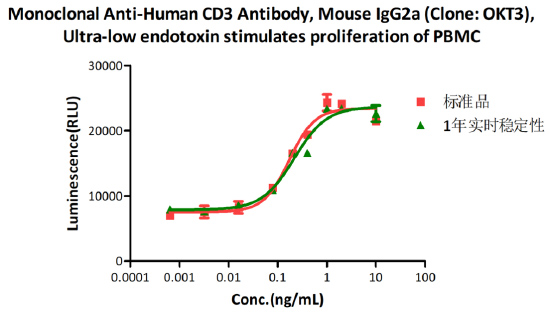
The Cell based assay shows that Monoclonal Anti-Human CD3 Antibody (Cat. No. CDE-M120a) is stable at 4°C for 1 year.
模拟运输稳定性:
The Cell based assay shows that Human IL-15 (Cat. No. GMP-L15H13) is stable at 37°C for 14 days.
精准定量
生物制药开发过程往往需要实验中所使用的蛋白试剂浓度准确,避免虚高,同时批间装量严格一致,这就对蛋白试剂的生产过程中准确定量提出更高的要求。同时,严格的方法验证也很重要。
针对不同的蛋白,参照ICH Q2和中国药典标准,使用国家标准品进行溯源,我们完成了充分的方法验证,结果显示,方法重复性不同人不同天分别CV<3%,回收率在90-108%之间,确保定量结果的准确性。
分析方法溯源数据:
| 验证项 |
检测方法 |
溯源方法 |
| 验证标准 |
验证结果 |
验证标准 |
验证结果 |
| 重复性 |
RSD≤3% |
0% |
RSD≤3% |
1% |
| 同天不同人 |
RSD≤3% |
0% |
RSD≤3% |
3% |
| 同人不同天 |
RSD≤3% |
0% |
RSD≤3% |
3% |
| 准确度 |
90%-108% |
100%-106% |
90%-108% |
97%-103% |
| 耐用性 |
RSD≤3% |
0% |
RSD≤10% |
<10% |
| 线性&范围 |
R2>0.999 |
0.9996 |
R2>0.999 |
0.9999 |
| 专属性 |
/ |
/ |
90-110% |
96% |
蛋白质的定量有多种方法,如常用的紫外分光光度法(UV 280)、Folin-酚法(Lowry法)、BCA法、Bradford法等,这些方法基于不同的原理,也各有其优点和局限性。比如,紫外吸收法,只要根据氨酸序列计算出摩尔消光系数,就可以非常快速的根据样品在280nm下的吸收值进行蛋白定量,仪器设备没有特殊要求,操作简单不需要特殊培训等,成为多数实验室最常用的方法。但是紫外吸收法易受紫外吸收杂质的干扰,比如残留的痕量核酸,各种具有紫外吸收的成分或物质,都会直接影响UV280的吸收,造成蛋白浓度测定值虚高,同时造成因定量不一致引起的批间差异等问题。
ACROBiosystems百普赛斯针对这些问题,每批蛋白原液和成品定量过程中,同时采用包括紫外吸收法和BCA法(改进的Folin-酚法)在内的多种不同的定量方法,同时对每个蛋白产品分别建立定量标准品和标准批次,从根本上避免了任何一种单一方法因自身局限性引起的蛋白定量误差,同时保证同一产品不同批之间定量一致,带给客户最小的批间差异。
纯度/分子量质控
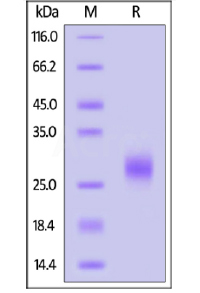
为满足生物制药领域客户对高纯度蛋白的需求,ACROBiosystems百普赛斯同时采用SDS-PAGE、SEC-HPLC、SEC-MALS,DLS等多种方法进行产品的纯度和均一度检测。
SDS-PAGE:
ActiveMax® Human VEGF165, Tag Free (MALS verified) on SDS-PAGE under reducing (R) and non-reducing (NR) conditions. The gel was stained overnight with Coomassie Blue. The purity of the protein is greater than 98%.
SDS-PAGE:
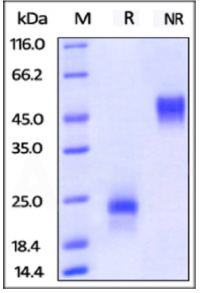
Human IL-7 on SDS-PAGE under reducing (R) condition. The gel was stained overnight with Coomassie Blue. The purity of the protein is greater than 95%.
SEC-HPLC&SEC-MALS数据:
The purity of ActiveMax® Human VEGF165, Tag Free (MALS verified) (Cat. No. VE5-H4210) is more than 95% in HP-SEC, and the molecular weight of this protein is around 40-55 kDa verified by SEC-MALS.
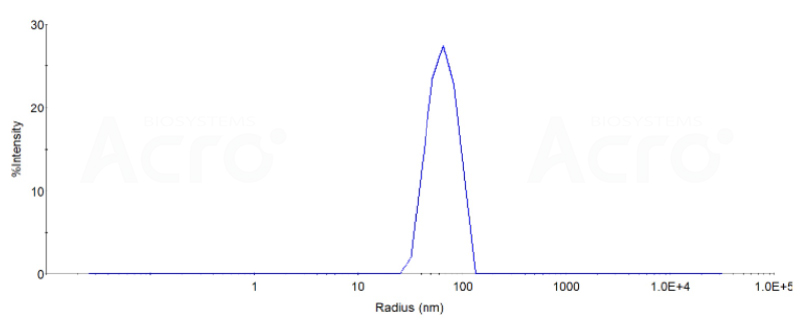
DLS数据:
The mean peak Radius of VLP is 60-80 nm with more than 95% intensity as determined by dynamic light scattering (DLS).
>>> 相关阅读:火眼金睛的SEC-MALS:准确测定蛋白分子量,确认蛋白聚体状态
多平台活性验证 (Bioactivity test)
药物的生物活性检测贯穿于生物制药研发和生产的始终,为更好的帮助生物制药领域的客户,ACROBiosystems百普赛斯建立了包括ELISA、SPR、Flow cytometry和Cell-based assay在内的多个活性分析平台,用以实现为生物制药领域的客户提供更好更稳定质量的产品和可参考的活性分析方案。
ELISA
Immobilized Human IL-17 RE (155-454), Fc Tag (Cat. No. ILE-H5256) at 2 μg/mL (100 μL/well) can bind Biotinylated Mouse IL-17C, His,Avitag (Cat. No. ILC-M82E9) with a linear range of 0.2-20 ng/mL (QC tested).
ELISA
Immobilized Human IL-15, Tag Free (Cat. No. IL5-H4117) at 5 μg/mL (100 μL/well) can bind Human IL-2 R beta, Fc Tag (Cat. No. ILB-H5253) with a linear range of 5-156 ng/mL (Routinely tested).
FACS
FACS assay shows that Biotinylated Human SIRP alpha, Fc,Avitag (Cat. No. CDA-H82F2) can bind to Jurkat cell expressing CD47. The concentration of SIRP alpha used is 3 μg/mL (QC tested).
FACS
FACS analysis shows that the binding of Biotinylated Human SIRP alpha, Fc,Avitag (Cat. No. CDA-H82F2) to Jurkat expressing CD47 was inhibited by increasing concentration of neutralizing Anti- Human CD47 antibody. The concentration of SIRP alpha used is 1 μg/mL. IC50=0.1303 μg/mL (Routinely tested).
Cell based assay
ActiveMax Human IL-7, Tag Free (Cat. No. IL7-H4219) stimulates proliferation of PHA-P-activated human peripheral blood mononuclear cell (PBMC). The EC50 for this effect is 1.565 ng/mL, corresponding to a specific activity of > 1.0 ⅹ10^8 IU/mg, which is calibrated against human IL-7 WHO International Standard (NIBSC code: 90/530) (QC tested).
SPR
Human IL-2 R beta Protein, His Tag (Cat. No. CD2-H5221) captured on CM5 chip via anti-His antibody, can bind Human IL-15, premium grade (Cat. No. IL5-H4117) with an affinity constant of 21.7 nM as determined in a SPR assay (Biacore T200) (Routinely tested).
批放行 (Batch release)
为确保产品质量的稳定性和高批间一致性,ACROBiosystems百普赛斯采用了批检放行策略,每一个新批次均会通过和相应标准品质量比较,只有与标准品达到同等高质量水平才会被批准放行,且每一个批次产品配有其专有的质控报告。
In the above ELISA analysis, three different lots of biotinylated hTNF-alpha (Cat. No. TNA-H82E3) were used detect immobilized Adalimumab (5ug/ml). The result showed that the batch variation among the tested samples is negligible.
Recombinant Human TNF-alpha (Cat. No.TNA-H4211) induces cytotoxicity effect on the WEH1-13VAR cells in the presence of the metabolic inhibitor actinomycin D. The ED50 for this effect is 0.007-0.014ng/ml. The result shows that the batch variation among the tested samples is negligible.
The binding affinity between Herceptin and different batches of FcRn / FCGRT & B2M Heterodimer Protein (Cat. No. FCM-H5286) were determined by SPR assay. The result shows that the batch variation among the tested different lots is negligible.
Bioactivity of three different lots of GMP Human IL-15 (GMP-L15H13) verified by cell-based assay, and the result shows very high batch-to-batch consistency.
分析方法验证(Validation of analytical method)
使用准确、可信的分析方法进行检测是产品得到严格质控的基础。针对GMP级别蛋白,我们参照ICH Q2 (R1)和《中国药典》分析方法验证相关指导原则进行完成了充分的分析方法验证,确保检测结果的准确性。
| 分析方法 |
验证类别 |
理论依据 |
验证项 |
| Lowry |
含量测定 |
参照ICH Q2(R1)和《中国药典》2020版第四部9101分析方法验证指导原则 |
专属性、准确度、精密度、线性、范围、耐用性 |
| SDS-PAGE |
鉴别 |
参照ICH Q2(R1)和《中国药典》2020版第四部9101分析方法验证指导原则 |
专属性、精密度、检测限、耐用性 |
| 内毒素 |
生物学测定方法 |
《中国药典》2020版第四部1143细菌内毒素检查法 |
标准曲线可靠性试验、供试品干扰试验 |
| 无菌 |
生物学测定方法 |
《中国药典》2020版第四部1101无菌检查法 |
培养基灵敏度检查、方法适用性试验 |
| 支原体 |
生物学测定方法 |
参照ICH Q2(R1)和《中国药典》2020版第四部9101分析方法验证指导原则 |
专属性、精密度、耐用性 |
| DNA残留 |
杂质测定/定量 |
参照ICH Q2(R1)和《中国药典》2020版第四部9101分析方法验证指导原则 |
专属性、准确度、精密度、定量限、线性、范围、耐用性 |
| 细胞活性 |
生物学测定方法 |
参照ICH Q2(R1)和《中国药典》2020版第四部9401生物制品 生物活性/效价测定方法验证指导原则 |
专属性、相对准确度、中间精密度、线性、范围 |
| HCP残留 |
杂质测定/定量 |
参照ICH Q2(R1)和《中国药典》2020版第四部9101分析方法验证指导原则 |
专属性、准确度、精密度、定量限、线性、范围、耐用性 |
| 卡那霉素残留 |
杂质测定/定量 |
参照ICH Q2(R1)和《中国药典》2020版第四部9101分析方法验证指导原则 |
专属性、准确度、精密度、定量限、线性、范围、耐用性 |
表1 细胞活性分析方法验证实例
| 项目类别 |
验证标准 |
验证结果 |
验证结论 |
专属性 |
阴性反应,干扰≤±20%。 |
平均RSD为5% |
符合规定 |
最大RSD为12% |
相对准确度 |
相对偏倚应在土12%范围内。 |
最大偏倚6% |
符合规定 |
回归方程斜率应在0.80~1.25范围内。 |
斜率1.11 |
中间精密度 |
不同日期,不同分析人员每个效价水平相对效价测定值的几何变异系数(GCV,%)应不大于20% 。 |
最大GCV15% |
符合规定 |
线性 |
直线回归方程的相关系数应不低于0.95。 |
0.96 |
符合规定 |
范围 |
涵盖产品效价质量标准的范围。 |
该方法涵盖64%-156%效价水平 |
符合规定 |
表2 酶活精密度验证实例
检测日期 |
检测次数 |
检测值 |
同天不同人
RSD |
员工A同人不同天
RSD |
员工B同人不同天
RSD |
员工A同天重复性
RSD |
员工B同天重复性
RSD |
不同人不同天
RSD |
员工A |
员工B |
DAY 1 |
1 |
1.49 |
1.52 |
1% |
5% |
4% |
2% |
3% |
6% |
2 |
1.46 |
1.48 |
1% |
3 |
1.52 |
1.52 |
0% |
4 |
1.49 |
1.47 |
1% |
5 |
1.45 |
1.40 |
3% |
6 |
1.51 |
1.51 |
0% |
DAY 2 |
1 |
1.36 |
1.56 |
9% |
2% |
3% |
2 |
1.33 |
1.53 |
10% |
3 |
1.39 |
1.60 |
10% |
4 |
1.39 |
1.58 |
9% |
5 |
1.32 |
1.52 |
10% |
6 |
1.39 |
1.61 |
11% |

1. 产品放行前的质控有哪些?
ACROBiosystems百普赛斯搭建了严格的质量控制体系,在质量控制方面,从生产原液到产成品,质量严格把关,使用多达20+项先进检测技术,历经30+次检测,4次审核,3次放行的全面质检流程。

点击查看ACROBiosystems百普赛斯质控流程
2. 什么是DMF?DMF归档有批准证书吗?ACROBiosystems百普赛斯产品是否在FDA申请了DMF备案?DMF备案的产品有哪些?
(1)DMF是“Drug Master File”的简称,译为“药品主文件”是关于产品化学、生产和质量控制(CMC,Chemistry, Manufacturing and Controls)信息的一套完整文件资料,内容包括产品的一般信息、生产工艺、杂质研究、稳定性等方面的资料和数据。包括涉及该产品的核心机密,如详细工艺描述、关键工艺参数、完整的物料信息等。DMF的状态有两种:
“A”=Active:激活状态,表示该DMF已获得归档号/登记号/备案号并被正常维护,可用;
“I”=Inactive:未激活状态,表示该DMF已被持有人或FDA关闭,不可用。
(2)没有证书,但会在FDA官网予以公示,所有人均可检索到。
(3)是的,ACROBiosystems百普赛斯于2020年7月首次实现重组蛋白试剂的DMF备案,是业内第一家重组蛋白通过FDA的DMF备案的公司。
(4)到目前为止共对33个货号的产品进行了DMF备案,未来还将持续对更多产品进行DMF备案。点击链接了解更多DMF备案详情
如您有IND/BLA等申报需要,请联系quality@acrobiosystems.com,获取LOA授权信。另外,ACROBiosystems百普赛斯预计于2022年中,完成所有GMP产品的DMF备案。
3. ACROBiosystems百普赛斯如何确保产品质量?
产品质量控制是一个综合的控制体系,ACROBiosystems百普赛斯的控制策略包括:对原材料的控制和检验;按照规范的SOP对中间品、半成品和终产品进行测试等,以确保产品质量自始至终得到有效控制和保证。产品放行由有资质的授权人员进行操作,供应商审核根据需要进行。 另外也会通过监控产品投诉、不合格品、纠正和预防措施计划等监控质量控制的有效性。
4. ACROBiosystems百普赛斯 RUO和GMP产品之间的区别?
| |
ACROBiosystems百普赛斯-RUO 产品 |
ACROBiosystems百普赛斯-GMP 产品 |
产品种类 |
多数靶点蛋白产品 |
GMP级别细胞因子/酶/抗体等产品 |
应用 |
仅供研究使用 |
为满足临床阶段需求而设计,用于商业化生产 |
质量体系 |
ISO9001/ISO13485质量体系认证 |
ISO+GMP质量体系 |
生产 |
普通级别厂房生产 |
GMP级别洁净厂房生产 |
多数为瞬转 |
稳定株(外检) |
多数AOF原材料 |
AOF原材料 |
关键辅料非药用级 |
关键辅料药用级 |
经过除菌过滤 |
经严格二级除菌过滤 |
手动罐装 |
B+A全自动灌装 |
无病毒去除/灭活工艺 |
病毒去除/灭活步骤 |
检测 |
无菌/支原体检测非必检项(仅适用于部分产品) |
无菌/支原体检测 |
内毒素非必检项 |
内毒素控制及检测 |
分析方法、检测仪器未做严格验证 |
关键分析方法、检测仪器严格验证 |
无全面安全性相关检测 |
全面安全性检测 (病毒/异常毒性/急毒/残留DNA/HCP检测/残留抗生素检测) |
文档 |
有限法规支持文件(COA, COO, MSDS等文件) |
全面的两级法规支持文档RSF |
如需填写供应商调查表或出具质量声明,请点击按钮 联系我们!
quality@acrobiosystems.com






















 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!































 膜杰作
膜杰作 Star Staining
Star Staining