在肿瘤治疗领域,以肿瘤微环境中Treg细胞为主的介导免疫抑制相关的负调节机制严重影响了免疫细胞对于肿瘤细胞的识别和杀伤,严重制约了肿瘤的治疗。目前针对于Treg等免疫调节细胞的药物开发,也成为了肿瘤治疗领域的热门之一。例如百时美施贵宝(BMS)开发的针对CTLA-4靶点的伊匹单抗(Ipilimumab),通过与靶向肿瘤细胞的药物联合使用,获得了更好的肿瘤抑制效果(Checkmate-650 (Nivolumab + Ipilimumab治疗mCRPC))。
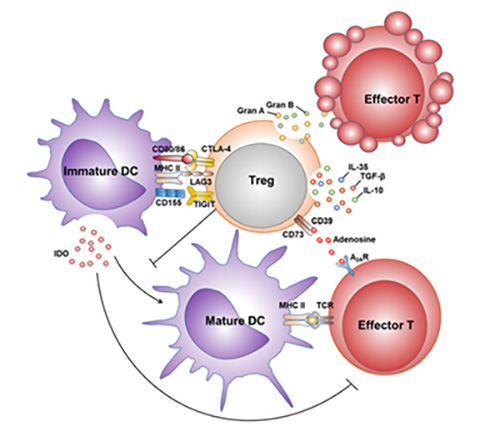
肿瘤微环境中Treg介导的免疫调节机制
然而,CTLA-4等免疫调节相关靶点在正常组织中的免疫细胞中也存在表达,靶向该类靶点的药物或存在潜在的安全风险。相比而言,CCR8在肿瘤微环境中的表达水平更加特异(在肿瘤浸润的Treg细胞上特异性表达,而在外周血Treg或正常组织上基本不表达),使其具有更有效、更安全的药理优势,正作为肿瘤免疫中极具潜力的免疫调节类靶点受到业界的关注。
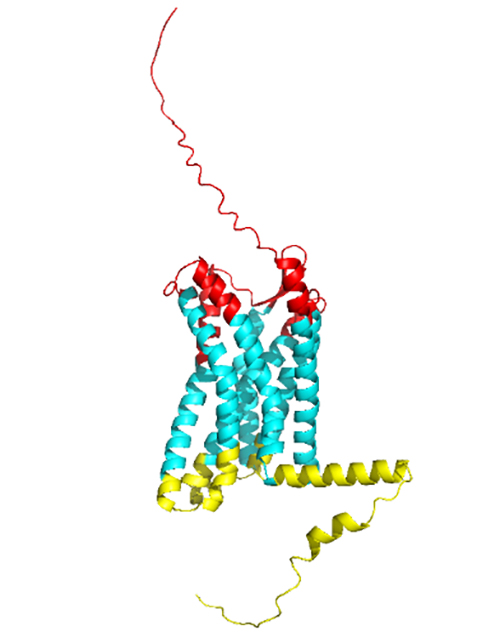
CCR8结构图(红色、蓝色、黄色依次表示胞外区、跨膜区、胞内区)
CCR8属于GPCR类蛋白,由355个氨基酸构成了七次跨膜的结构(Uniprot ID: P51685),是趋化因子受体亚家族的成员,主要在单核细胞、Th2细胞和调节性T细胞(Treg)细胞上表达。CCR8的配体是趋化因子CCL1(也被称为I-309),可增加肿瘤微环境中的骨髓来源的抑制性细胞(Myeloid-derived suppressor cells, MDSC)的白细胞介素6(IL-6)的表达,进而起到促炎作用。

CCL1/CCR8通路示意图
在炎症部位或肿瘤微环境中,传统的FOXp3+ Treg细胞分泌产生CCL1但不表达其靶受体CCR8, 仅一小部分FOXp3+ Treg细胞在表面表达CCR8,CCL1可增强这些CCR8+的Treg细胞在调节免疫反应中的活性,进而基于CCL1-CCR8通路抑制肿瘤微环境中的免疫活性,使得抗肿瘤免疫效果降低。因此,靶向CCR8可阻断CCL1/CCR8通路,有效调节肿瘤微环境中的免疫活性从而用于肿瘤免疫治疗。
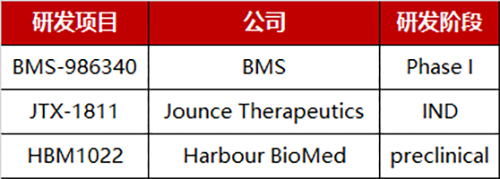
目前,针对CCR8的药物研发管线布局不多。最引人瞩目的是,BMS于2021年5月启动了BMS-986340单克隆抗体的I期临床,评估其与Nivolimumab(靶向PD-1)联用对实体瘤的治疗效果,该药物随即成为全球第一个进入临床阶段的靶向CCR8的抗体药物。吉利德也于2020年9月从Jounce Therapeutics公司获得了靶向CCR8的JTX-1811抗体药物的合作开发权力。国内和铂医药、普米斯生物等企业也布局了CCR8领域。
近年来的研究表明,相比于CTLA-4、CCR4等Treg细胞的相关靶点蛋白,CCR8在肿瘤浸润的Treg细胞中的表达高度特异,其主要配体CCL1能够与肿瘤微环境中的Treg细胞上的CCR8结合,起到免疫抑制作用。开发靶向CCR8的药物有望特异性地针对肿瘤微环境中的Treg细胞,阻断CCL1/CCR8相互作用,起到上调肿瘤微环境的免疫水平的目的,展现出更有效更安全的优势。
全长七次跨膜蛋白CCR8
(Cat. No. CC8-H52P4)
天然完整构象,生物活性经抗体结合验证
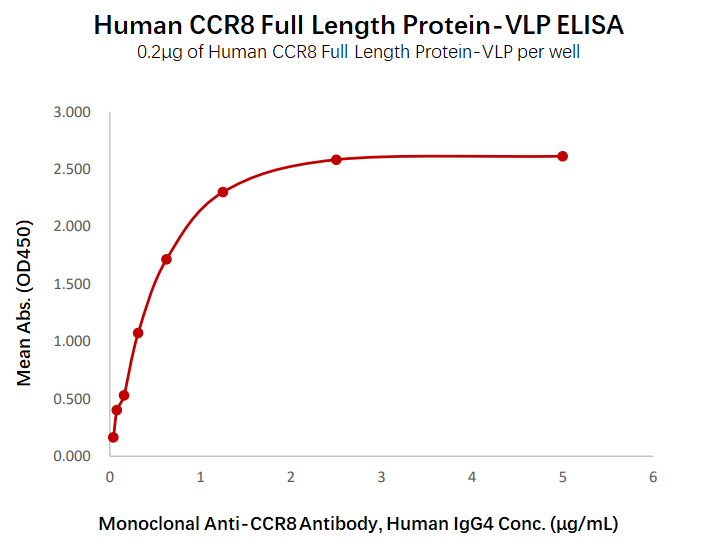
经ELISA验证,Human CCR8-VLP(Cat. No. CC8-H52P4)可以与anti-CCR8单克隆抗体特异性结合






















 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!































 膜杰作
膜杰作 Star Staining
Star Staining















