自然杀伤(natural killer, NK)细胞是先天免疫系统的重要效应细胞,能够迅速识别和消除感染、应激和恶性细胞。不同于T细胞和B细胞表达抗原识别受体TCR和BCR,NK细胞无需抗原预先致敏就能破坏靶细胞(如病毒感染的细胞、某些肿瘤细胞和受损伤的细胞),且其杀伤无MHC限制性,应答速度快,在免疫应答的早期即可发挥作用,这也是NK细胞之所以被称为自然杀伤细胞的重要原因。
NK 细胞在癌症中的作用机制
NK细胞可以作为先天细胞毒效应因子,调节先天免疫和适应性免疫。应激诱导配体(“诱导自我”)和MHC I表达下降(“迷失自我”)水平分别可被NK细胞上的活化受体和抑制受体识别,二者的平衡决定了NK细胞的活化状态。NK细胞活化后,通过颗粒酶B和穿孔素分泌颗粒诱导靶细胞裂解,死亡受体/配体相互作用和抗体依赖的细胞细胞毒性(ADCC)。另一方面,激活NK细胞可以分泌一系列促进DC成熟和募集的细胞因子和趋化因子,进一步调节T细胞反应,包括细胞毒性CD8+ T细胞和Th细胞活化。
ADCC是一个涉及NK细胞激活、释放细胞因子和溶细胞颗粒以及诱导靶细胞凋亡的过程,主要由低亲和力介导Fc受体CD16 (FcγRIIIA或CD16a)。CD16是激活NK细胞效应的受体,通过信号传导,诱导免疫受体酪氨酸基激活基序(ITAM)磷酸化,触发溶解颗粒和细胞因子如IFN-γ和TNF-α的释放。此外,当NK细胞与靶细胞相互作用时,NK细胞中CD16发生下调,这是NK细胞活化过程中CD16外域脱落的结果。NK细胞的CD16脱落是由跨膜糖蛋白,崩解素和金属蛋白酶17或ADAM17介导的。这都显示了CD16在触发NK细胞介导的ADCC中的核心重要性。
在免疫治疗中利用自然杀伤细胞的创新技术引入了双特异性杀伤细胞接合器( bi-specific killer cell engagers, BiKEs) 和三特异性杀伤细胞接合器( tri-specific killer cell engagers,TriKEs) 的概念。 BiKEs是由抗CD16的scFv和对抗肿瘤相关抗原scFv融合创建的。TriKEs是抗CD16和两种肿瘤相关抗原的scFv组合。这些分子通过CD16直接激活NK细胞,扩增NK细胞,产生细胞因子,对各种肿瘤细胞抗原的杀伤活性。TriKEs通常由特异性单克隆抗体的可变结构域基因产生。在这种情况下,抗原结合位点1是二价的,并与效应细胞上的抗原结合,抗原结合位点2和3与肿瘤细胞上的抗原1和2结合。
三特异性抗体示意图
通过CD16直接激活NK细胞,促进NK细胞与肿瘤细胞间免疫突触的形成,对各种肿瘤细胞抗原的杀伤活性,多种 BiKEs和TriKEs 药物目前正在临床前研究中。
BiKEs 和TriKEs 药物研发进展(药渡数据)
AFM13 是由Affimed公司开发的first-in-class四价 BiKEs ,其特征是双价结合CD30和CD16a (FcγRIIIA)。
AFM13 的结构
AFM13与CD30+ 恶性肿瘤的结合增强了NK细胞的活化,增强了细胞毒性和细胞因子和趋化因子的分泌 , AFM13在CD30+ 恶性肿瘤的单药治疗和与抗PD-1联合治疗中都显示出了很好的疗效数据。 基于其良好的安全性, AFM13适合与其他方法联合诱导具有增强识别和杀伤肿瘤靶点能力的NK细胞,作为潜在的免疫治疗方法 。
AFM13 的作用机制
AFM24同样来自Affimed公司,是利用重定向优化的细胞杀伤(Redirected Optimized Cell Killing,ROCK® )抗体平台开发的一种新的双特异性IgG1-scFv融合抗体,针对先天免疫NK细胞上的CD16a和肿瘤细胞上的EGFR。研究表明,AFM24可在低纳摩尔范围内结合NK细胞和巨噬细胞上的CD16a,并与多种表达EGFR的肿瘤细胞结合。AFM24在体外通过NK细胞介导的抗体依赖细胞的细胞毒性和巨噬细胞介导的抗体依赖细胞的吞噬作用中都是高效有效的。更重要的是,AFM24对多种EGFR表达的肿瘤细胞有效,针对各种实体肿瘤,如结直肠癌或肺癌等,而与EGFR表达水平和KRAS/ BRAF突变状态无关。体内实验数据表明,每周给药一次,持续28天,食蟹猴对AFM24的耐受达到了最高剂量(75 mg/kg),且没有观察到皮肤和其他毒性。所有剂量在2-4小时后均检测到的IL-6短暂升高,24小时后恢复到基线水平。这些结果证明了AFM24有效靶向表达不同水平EGFR的肿瘤的潜力,无论其突变状态如何,并强调了 BiKEs 作为一种替代癌症治疗的前景。
AFM24 的结构模型
61533 TriKE 的结构
61533 TriKE 结合了anti-CD16 scFv与anti-CD33 scFv,并在两者之间插入 IL-15作为连接因子,扩增NK细胞,增强其介导的对CD33髓细胞靶点的杀伤。被称为第一代TriKE分子的161533(scFv16-m15-33),含有一个N72D替换的突变体IL15(m15),目前一项I/II期临床试验正在进行中,用于治疗难治性AML、高风险MDS和系统性肥大细胞增多症(NCT03214666)。有进一步的研究,用人源化的抗CD16单结构域纳米抗体取代anti- CD16单链抗体,改善了中IL-15部分的功能,较小的sdAb尺寸也可能减少空间位阻,从而更有效地呈现IL15,减少错配。使用野生型IL-15产生的分子cam16-wt15-33 TriKE,比scFv16-m15-33显示出更强的IL-15信号能力,更好的NK细胞活化,增加NK细胞介导的肿瘤控制。
TriKE平台在NK衔接器中是独一无二的,因为它融合了细胞因子信号、特异性肿瘤靶向和单个分子内ADCC的激活。总之,TriKEs不仅驱动特异性肿瘤杀伤,而且通过IL-15片段诱导NK细胞增殖和存活。
虽然大多数 BiKEs和 TriKEs目前处于临床前阶段,但它们增强NK细胞介导的针对靶点的细胞毒性的能力在治疗癌症患者方面具有很大的前景。在临床使用前,需要进一步调查评估BiKE和TriKE的安全性和有效性。人类CD16有两种亚型,CD16a和CD16b,它们的免疫球蛋白结合区域有96%的序列相同。CD16a在NK细胞、巨噬细胞和肥大细胞上表达,是一种激活受体。CD16b作为GPI锚定受体在粒细胞上表达,不触发肿瘤细胞杀伤。 目前,大多数靶向CD16的抗体都不能区分CD16a和CD16b亚型,但CD16b亚型不能引发对肿瘤细胞的杀伤作用,并可能会引发副作用,因此,特异性靶向CD16a尤为重要,这也是 Affimed 核心技术之一。
ACROBiosystems 为助力抗体药物开发,实现抗体的Fc区域功能验证,已成功开发 一系列高质量Fc受体蛋白 产品。其中包括 Human FcγRIIIA/CD16a 及其96%同源性的 FcγRIIIB/CD16b (NA1和NA2) , Mouse 、Cynomolgus、Rhesus macaque FcγRIII/CD16 , Mouse FcγRIV/CD16-2 ,全面为靶向 FcγRIIIA/CD16a 的研究及药物开发加速。
Human与Mouse的FcγRs
如图所示,Human的FcγRs分为 FcγRI/CD64, FcγRII/CD32 (FcγRIIa/CD32a, FcγRIIb/CD32b和FcγRIIc/CD32c) 和FcγRIII/CD16 (FcγRIIIA/ CD16a和FcγRIIIB/CD16b) 。Mouse的FcγRs分为FcγRI/CD64、FcγRII/CD32、FcγRIII/CD16和FcγRIV/CD16-2,基于同源性、亲和力、功能的相似性,分别被描述为Human FcγRI/CD64、 FcγRIIB/CD32b、FcγRIIA/CD32a和FcγRIIIA/CD16a的等效物, FcγRI /CD64、FcγRIII/CD16、FcγRIV/CD16-2表现出与人类相应的激活特性,FcγRII表现出与人类FcγRIIB一样的抑制功能。
✔ HEK293细胞表达 :
✔ 多种属 : Human种属的FcγRIIIA/CD16a和FcγRIIIB/CD16b,Mouse、Cynomolgus、Rhesus macaque种属的FcγRIII/CD16,Mouse种属FcγRIV/CD16-2,可应用于抗体候选物与不同种属CD16的亲和力检测。
✔ 覆盖天然突变型 (突变位点为包含信号肽序列计数)
✔ 提供采用AvitagTM 定点标记的生物素化CD16系列蛋白 ,标记效率高且标记位点专一明确,方便药物开发及工艺优化过程中基于与链霉亲和素结合的ELISA/SPR/BLI检测
✔ 高纯度 :SDS-PAGE验证纯度>95%,SEC-MALS验证纯度>90%
✔ 低内毒素 :<1.0 EU/μg
✔ 高稳定性 :严格质控为高批间一致性保驾护航
✔ 亲和力经SPR&BLI验证 :活性有保障,免费提供实验方案(protocol)
分子
货号
产品描述
结构
Fc gamma RIIIA /
CD8-H52H4
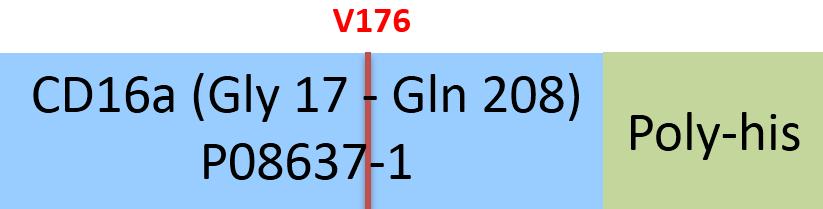
Human Fc gamma RIIIA / CD16a (V176) Protein, His Tag (SPR & BLI & MALS verified)
CDA-H5220
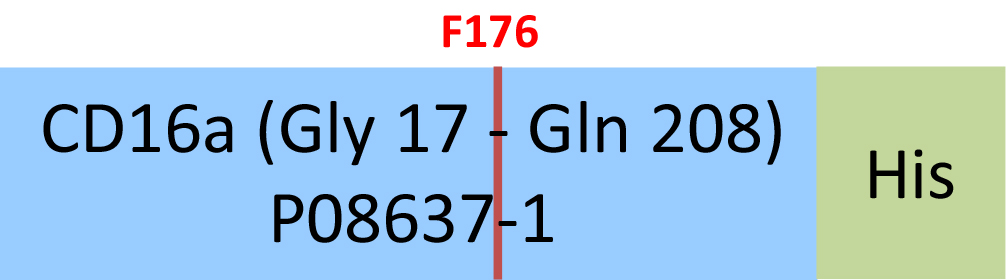
Human Fc gamma RIIIA / CD16a (F176) Protein, His Tag (SPR & BLI & MALS verified)
CDA-H5290
Human Fc gamma RIIIA / CD16a (V176) Protein, SUMO,His Tag (MALS & BLI verified)
CDA-H52H6
Human Fc gamma RIIIA / CD16a (F176, S197P) Protein, His Tag (MALS & SPR verified)
CDA-H52S1
Human Fc gamma RIIIA / CD16a (V176) Protein, HSA,His Tag (MALS & BLI verified)
CDA-H82E8
Biotinylated Human Fc gamma RIIIA / CD16a (F176) Protein, Avitag™ ,His Tag (SPR & BLI & MALS verified)
CDA-H82E9
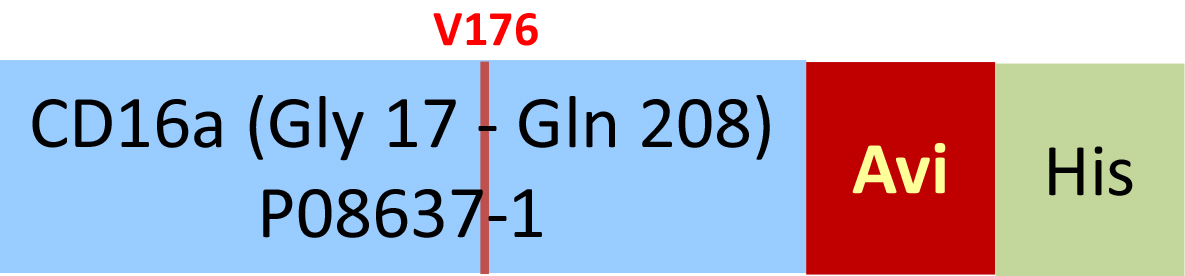
Biotinylated Human Fc gamma RIIIA / CD16a (V176) Protein, Avitag™ ,His Tag (SPR & BLI verified)
Fc gamma RIIIB /
CDB-H5227
Human Fc gamma RIIIB / CD16b (NA1) Protein, His Tag (SPR & BLI & MALS verified)
CDB-H5296
Human Fc gamma RIIIB / CD16b (NA1) Protein, SUMO,His Tag (MALS & BLI-verified)
CDB-H82E4
Biotinylated Human Fc gamma RIIIB / CD16b (NA1) Protein, His, Avitag™ (SPR & BLI & MALS verified)
Fc gamma RIIIB /
CDB-H5222
Human Fc gamma RIIIB / CD16b (NA2) Protein, His Tag (SPR & BLI & MALS verified)
CDB-H5294
Human Fc gamma RIIIB / CD16b (NA2) Protein, SUMO,His Tag (MALS & BLI-verified)
CDB-H82Ea
Biotinylated Human Fc gamma RIIIB / CD16b (NA2) Protein, His, Avitag™ (SPR & BLI & MALS verified)
Fc gamma RIII /
CDA-M52H8
Mouse Fc gamma RIII / CD16 Protein, His Tag (SPR & BLI & MALS verified)
FC6-M82E0
Biotinylated Mouse Fc gamma RIII / CD16 Protein, His, Avitag™ (MALS & SPR verified)
FC6-C52H9
Cynomolgus Fc gamma RIII / CD16 Protein, His Tag (MALS & BLI verified)
FC6-C82E0
Biotinylated Cynomolgus Fc gamma RIII / CD16 Protein, His, Avitag™ (MALS & BLI verified)
FC6-R52H6
Rhesus macaque Fc gamma RIII / CD16 Protein, His Tag (SPR & BLI & MALS verified)
Fc gamma RIV /
FC4-M52H3
Mouse Fc gamma RIV / CD16-2 Protein, His Tag (MALS verified)
FC4-M82E8
Biotinylated Mouse Fc gamma RIV / CD16-2 Protein, His, Avitag™ (BLI verified)
高纯度经SDS-PAGE及SEC-MALS验证:纯度高于95%
经SDS-PAGE验证,CD16a (V176), His Tag (Cat. No. CD8-H52H4 )纯度高于 95%;经 SEC-MALS 验证,CD16a (V176), His Tag (Cat. No. CD8-H52H4 )纯度高于 95%,分子量为35-45 kDa。
生物活性经SPR验证
经SPR验证,固定在SA芯片上的生物素化Human CD16a (F176), Avitag,His Tag (Cat. No. CDA-H82E8 )可以与Rituximab 特异性结合,亲和力常数为1.33 μM (Biacore T200) 。
经BLI验证,装载在SA 生物传感器上的生物素化Human CD16b (NA1), His,Avitag (Cat. No. CDB-H82E4 ) 可以特异性结合Rituximab,亲和力常数为7.7 μM (ForteBio Octet Red96e)。
参考文献
next big thing in solid tumor therapeutics. Molecular Medicine. 2018, 24:50. https://doi.org/10.1186/s10020-018-0051-4
4. Jingjing Wu, Jiaping Fu, et al. AFM13: a first-in-class tetravalent bispecific anti-CD30/CD16A antibody for NK cell-mediated immunotherapy. Journal of Hematology & Oncology. 2015, 8:96. DOI 10.1186/s13045-015-0188-3
5. Uwe reusch, Carmen Burkhardt, et al. A novel tetravalent bispecific TandAb(CD30/CD16A) efficiently recruits NK cells for the lysis of CD30+ tumor cells. mAbs, 2014, 6:3, 728–739 . DOI: 10.4161/mabs.28591
6. Susanne Wingert, Uwe Reusch, et al. Preclinical evaluation of AFM24, a novel CD16A specific innate immune cell engager targeting EGFR-positive tumors. mAbs, 2021, 13:1. DOI: 10.1080/19420862.2021.1950264
7. Martin Felices1, Todd R. Lenvik, et al. Potent Cytolytic Activity and Specific IL15 Delivery in a 2nd Generation Trispecific Killer Engager. Cancer Immunol Res. 2020, 8(9): 1139–1149. doi:10.1158/2326-6066. CIR-19-0837
8. Antibody Drug Discovery Downloaded from www.worldscientific.com




















 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!

































 膜杰作
膜杰作 Star Staining
Star Staining