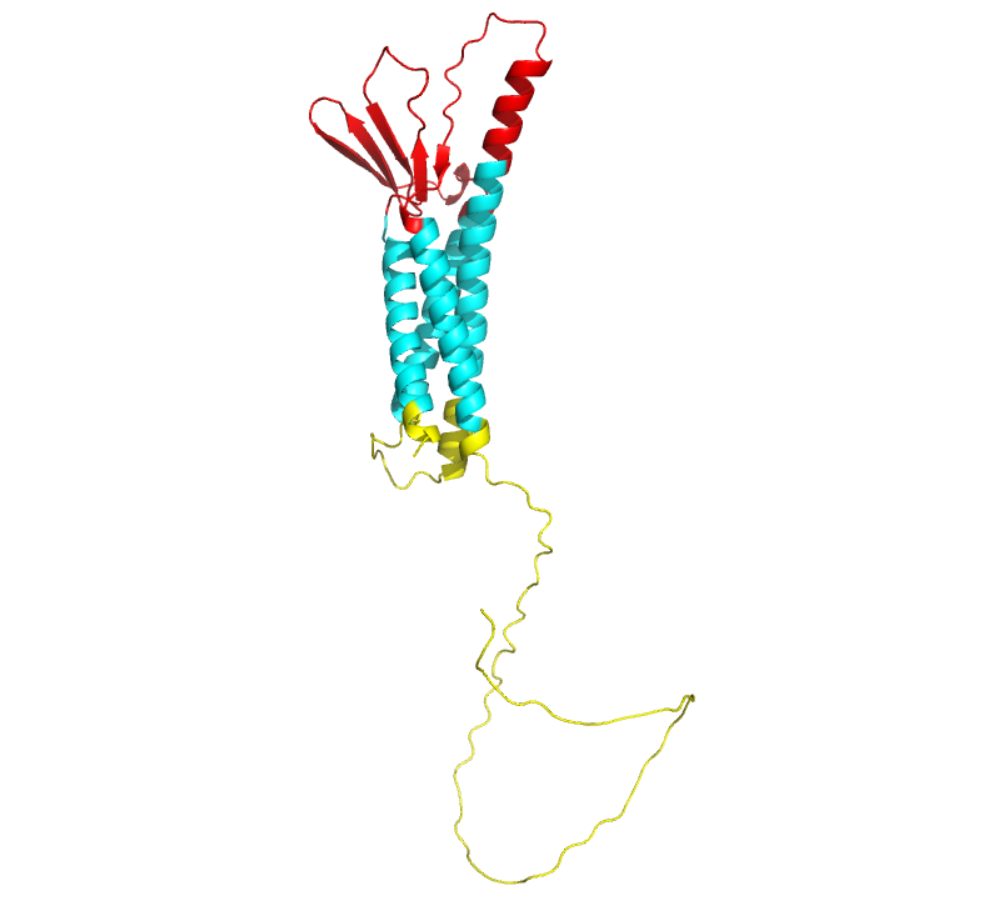
Claudin18.2结构(红色、绿色、黄色分别代表胞外区、跨膜区、胞内区)
四次跨膜蛋白Claudin18.2 属于紧密连接蛋白 Claudins 家族,具有高度特异性,在健康组织中仅表达于胃黏膜上皮细胞,而在包括胃癌和胰腺癌等多种癌症中高表达:胃(70-80%)、胰腺(60%),已成为潜在的抗肿瘤药物有效分子靶点,受到不少制药企业的关注和布局。
下面,小编为大家梳理了2021年度靶向Claudin18.2临床研究的大事件。
2021年12月28日,君实生物JS107注射液的临床试验申请获得NMPA受理。
JS107是由君实生物自主研发的注射用重组人源化抗Claudin18.2单克隆抗体与MMAE(Monomethy lauristatin E,单甲基澳瑞他汀E, IC50在亚纳摩尔等级范围内的有效微管蛋白结合剂)偶联的ADC药物,拟用于治疗胃癌和胰腺癌等晚期恶性肿瘤。
JS107可以与肿瘤细胞表面的Claudin18.2结合,通过内吞作用进入肿瘤细胞内,释放小分子毒素MMAE,对肿瘤细胞产生强大的杀伤力。JS107还保留了ADCC及CDC效应,进一步杀伤肿瘤细胞。并且由于MMAE的细胞通透性,JS107能够通过旁观者效应介导对其它肿瘤细胞的无差别杀伤,从而提高疗效并抑制肿瘤复发。临床前体内药效试验显示,JS107具有显著的抑瘤效果。此外,动物对JS107的耐受性良好,JS107表现出较好的安全性。
此前,君实生物自主研发的重组人源化抗Claudin18.2单克隆抗体JS012注射液已于2021年11月获得NMPA批准开展临床试验。
12月15日,天境生物宣布,NMPA药品审评中心(CDE)已正式批准双特异性抗体TJ-CD4B(又称ABL111,与韩国ABL Bio合作开发)治疗实体瘤(包括胃癌、食管胃交界腺癌、食管腺癌和胰管腺癌)的I期临床研究。天境生物已于今年6月在美国获批启动了TJ-CD4B用于治疗晚期实体瘤的I期临床试验(NCT04900818),此次在中国获批的I期临床试验将作为美国研究的剂量扩展部分开展,以全面提速TJ-CD4B的全球临床开发进程。

Claudin18.2×4-BB双抗/TJ-CD4B的设计
TJ-CD4B作为临床阶段首款靶向肿瘤抗原Claudin18.2和T细胞共刺激分子4-1BB的创新双特异性抗体,具有独特的4-1BB结合表位,使其仅在与Claudin18.2结合时才会激活T细胞。这一特性能避免因4-1BB广泛表达而过度激活T细胞所引起的肝毒性并降低全身免疫反应风险。TJ-CD4B与这两个靶点特异结合后,可增加淋巴细胞肿瘤浸润并增强肿瘤免疫应答,具有治疗胃癌、胰腺癌及多种恶性实体肿瘤的潜力。临床前研究表明,即便在Claudin18.2低表达的情况下,TJ-CD4B仍能与肿瘤病灶结合,并产生优于其它4-1BB单克隆抗体的免疫活性。在11月份的2021年癌症免疫治疗学会(SITC)年会上公布的临床前研究数据显示,TJ-CD4B具有独特的4-1BB结合表位和作用机理,具有降低全身免疫反应风险和持久的抗肿瘤疗效的优势。
11月29日,荣昌生物凭借全面集成的ADC平台自主研发的靶向Claudin18.2的ADC药物RC118 I期临床试验,在澳大利亚完成首例患者入组给药,适应症为“标准治疗无效或无法耐受标准治疗的局部晚期不可切除或转移性恶性实体肿瘤”。这是荣昌生物在推动产品管线全球化布局方面的重要举措。
RC118是荣昌生物第四款进入临床研究的ADC。它由重组的人源化抗Claudin18.2单克隆抗体和小分子微管抑制剂MMAE作为payload,通过可被组织蛋白酶可剪切的连接子(Linker)彼此偶联而成,并具有优化的药物-抗体比率。Ⅰ期临床研究将围绕Claudin18.2表达阳性患者的各类实体瘤展开。

11月15日,细胞治疗企业科济药业发布公告,其开发的全球首款Claudin18.2 CAR-T候选产品CT041已被欧洲药品管理局(EMA)授予优先药物(PRIME)资格,用于治疗胃癌/胃食管结合部癌。值得一提的是,这也是全球首个入选PRIME计划的实体瘤CAR-T产品。
根据科济药业在今年欧洲肿瘤内科学会年会(ESMO 2021)上公布的I期临床试验数据,截至2021年4月8日,37例Claudin18.2表达阳性的晚期消化系统肿瘤患者接受CT041输注并完成至少12周的评估。安全性方面:CT041耐受性良好,未发生治疗相关死亡或免疫细胞治疗相关神经系统毒性综合征(ICANS)。约95%的患者发生细胞因子释放综合征(CRS),均为1级或2级。有效性方面:在36例具有肿瘤靶病灶的患者中,31例患者观察到不同程度的靶病灶缩小,ORR为48.6%,DCR为73.0%。
在既往至少2线治疗失败、接受II期推荐剂量(RP2D)2.5×10⁸ CAR-T细胞治疗的18例胃癌/胃食管结合部癌患者中,8例(44%)患者既往接受过抗PD-(L)1单抗治疗。中位随访时间为输注后7.6个月, ORR为61.1%,DCR 为 83.3%,中位PFS和中位OS分别为5.6个月和9.5个月。同时,科济药业开发了创新的 FNC 预处理方案,在使用环磷酰胺和氟达拉滨传统方案的基础上,加入白蛋白结合型紫杉醇进行淋巴细胞清除,以改变免疫微环境,提高 CT041在肿瘤组织局部的渗透性及持久性。

2021年10月14日,礼新公司核心产品之一的ADC药物LM-302正式取得中国NMPA IND批件,开展的临床研究是一项随机、多中心临床试验,旨在初步评估LM-302产品的安全用药剂量和初步的有效性。同年6月,LM-302已经取得美国FDA IND批件,并获得FDA孤儿药资格认定(胰腺癌,胃癌及胃食管交界部癌)。
LM-302是一个礼新医药拥有自主知识产权和全球权益的基于Claudin18.2抗体偶联药物的I类新药,目前处于中、美I期临床阶段。LM-302能特异靶向Claudin18.2阳性的肿瘤细胞并通过内吞进入肿瘤细胞,释放小分子毒素,从而起到抗肿瘤作用。LM-302临床前研究数据显示出良好的安全性及体内外活性,尤其在Claudin18.2低表达的肿瘤模型中也显示出良好的药效。4月3日,礼新医药的另外一款Claudin18.2抗体LM-102临床试验申请获NMPA受理。
2021年10月4日,再鼎医药在ClinicalTrials.gov网站登记了Claudin18.2抗体ZL-1211的美国1/2期临床,计划入组162例晚期实体瘤患者。
2021年9月23日,齐鲁制药的QLS31905(Claudin18.2/CD3双抗)I期临床试验项目在北京大学肿瘤医院召开线上启动会,标志该项目成功启动,进入入组受试者阶段。该项目于2021年7月27日获得NMPA药物临床试验默示许可。
QLS31905为齐鲁制药自主研发的靶向Claudin18.2和CD3的双特异性抗体,通过杂交瘤筛选、抗体可变区测序、嵌合抗体的筛选、序列的人源化改造,获得抗Claudin18.2和CD3分子,经筛选确定最终双特异件抗体候选分子。QLS31905能够通过CD3靶标招募T细胞到肿瘤部位,激活T细胞,特异性地杀伤高表达Claudin18.2的肿瘤细胞以提高疗效。
同样靶向Claudin18.2的齐鲁制药单抗药物QL1779注射液于2021年5月获批临床,用于治疗实体瘤患者。
9月2日,石药集团发布公告,附属公司上海新石生物医药有限公司已获得NMPA批准,可开展 NBL-015于中国的临床研究,评估NBL-015对晚期实体瘤患者的安全性、耐受性和药代动力学特性。NBL-015是由石药集团附属公司NovaRock Biotherapeutics Limited 发现及开发的一种全人源抗Claudin18.2单克隆抗体,用于治疗Claudin18.2阳性表达的晚期实体瘤,包括胰腺癌、胃癌(包括食道胃结合部癌),NBL-015经过蛋白工程优化,具有增强的ADCC、CDC和ADCP效应。临床前体外细胞杀伤实验和肿瘤小鼠模型中显示NBL-015较同类药物具有免疫原性低、安全性高、亲和力强及抗肿瘤活性高的显著优势,有望成为治疗胰腺癌和胃癌的同类最佳靶向药物。此前,NBL-015已获FDA颁发针对治疗胰腺癌和胃癌(包括食道胃结合部癌)的孤儿药资格认定,其IND申请亦已于2021年5月获美国FDA批准。7月16日,石药集团公告,其抗体药物偶联物SYSA1801的IND申请已获美国FDA批准,可开展Claudin18.2阳性表达的晚期胰腺癌的临床试验。I期临床试验将会评估SYSA1801 的安全性、耐受性、药代动力学特性及初步疗效。SYSA1801是一种创新(同类首创)的抗Claudin18.2 ADC药物。临床前体外和体内的动物试验显示该产品能有效通过抗Claudin18.2抗体靶向肿瘤细胞并发生内吞,将小分子毒素MMAE带入肿瘤细胞而起到抗肿瘤作用。临床前研究显示,该产品对胰腺癌具有优异的体内外活性和良好的安全性,极有希望在临床试验中展现出良好治疗效果。SYSA1801已于2021年获美国FDA颁发针对治疗胰腺癌的孤儿药资格认定。
2021年8月18日,创胜集团宣布其申办的TST001 I 期临床试验研究者会于8月14日顺利召开。与会的研究者认为TST001的Ⅰ期临床数据支持其进入扩展阶段的临床试验。创胜集团宣布TST001的Ⅱa期临床试验的第一例患者已于8月17日顺利完成给药。
TST001是由创胜集团自主开发的第二代靶向Claudin18.2的人源化抗体,相比IMAB362,TST001具有更高的亲和力和更强的NK细胞介导的ADCC肿瘤杀伤活性。TST001是一种高亲和力的靶向Claudin18.2的重组人源化单克隆抗体,基于创胜集团独立开发的免疫耐受突破(IMTB)技术平台开发。TST001可通过ADCC和CDC机制杀死表达Claudin18.2的肿瘤细胞。利用先进的生物加工技术,TST001的岩藻糖含量在生产过程中大大降低,进一步增强了TST001的ADCC介导的肿瘤杀伤活性。在小鼠异种移植实验中,TST001显示出比IMAB362类似物更强的抗肿瘤活性。
3月4日,CDE官网公示,启愈生物的“Q-1802冻干粉针”新药临床试验申请获得临床默示许可,适应症为晚期实体瘤。

2月27日,启愈生物宣布,公司首个计划在美国开展临床研究的创新药Q-1802今日获得美国FDA临床试验批准,适应症为晚期实体瘤。
Q-1802是启愈生物第一个临床申报项目,由启愈生物利用其抗体工程技术平台自主开发的,具有自主知识产权的可以同时靶向PD-L1及Claudin18.2的双特异性抗体。
2021年2月,根据CDE官网公示,明济生物的“ M108单抗注射液”临床试验申请获得默示许可,适应症为晚期实体瘤。

M108单抗注射液获得临床试验申请默示许可
M108单抗注射液是明济生物自主研发的针对靶点Claudin18.2癌症肿瘤抗原高表达的ADCC增强型单克隆抗体。通过增强型的ADCC效应充分调动患者机体的免疫细胞来杀伤肿瘤细胞。在体外和体内的抗体药效及理化性质等检测中,M108单抗注射液展示了较高的靶点特异性结合、较强的抗肿瘤活性和很好的安全性。
诚然,Claudin18.2因高特异性表达作为胃癌、胰腺癌等实体瘤靶点的潜力不容小觑,靶向Claudin18.2的药物研发可谓单抗、双抗、ADC、CAR-T百花齐放,颇有“乘势而上、聚势而强”的意味。
未来,我们期待国内生物制药行业针对潜力靶点诸多差异化设计和探索,在临床试验方面取得优势的疗效和安全性结果,为全球肿瘤患者带来生存福祉。
Claudin18.2系列产品及服务
验证数据
>>>经ELISA验证,全长Claudin18.2-VLP(CL2-H5547)可与抗Claudin18.2抗体特异性结合,线性区间为0.8-3ng/mL。

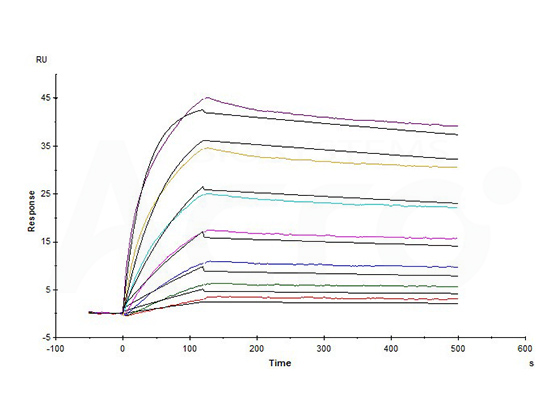
>>> 经SPR亲和力验证,全长Claudin18.2-VLP(CL2-H5547)可与抗Claudin18.2抗体特异性结合,响应信号高,亲和力常数为1.24 nM。
>>> 经ELISA验证, Claudin18.2-DDM/CHS(CL2-H5546)可与抗Claudin18.2抗体特异性结合,线性区间为0.4-2 ng/mL。
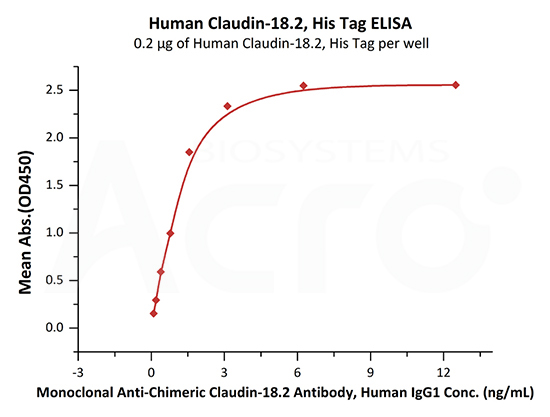
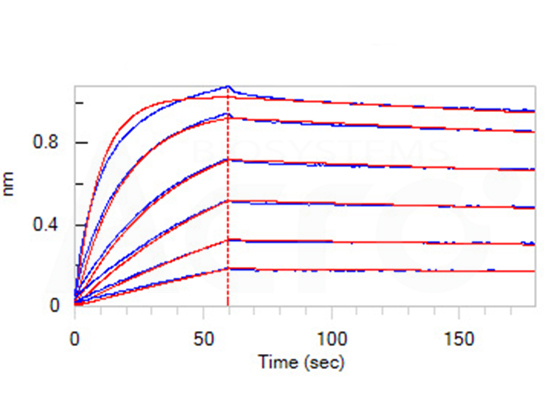
>>> 经BLI验证, Claudin18.2--DDM/CHS(CL2-H5546)可与抗Claudin18.2抗体特异性结合,亲和力常数为1.55nM。
>>> 经FACS验证,HEK293/ Claudin18.2稳定细胞株(CHEK-ATP033)可与抗Claudin18.2抗体特异性结合。

推荐阅读:
我们建立了一个开放、专业、有深度的膜蛋白技术分享交流群,聚焦多次跨膜靶点蛋白开发、应用等相关主题的讨论、热点文章分享和解读。希望大家能够更多的参与进来,讨论各类问题~

(请备注:公司+姓名)
1. 各公司官网
2. Wenqing Jiang et al. TJ-CD4B (ABL111), a Claudin18.2-targeted 4-1BB tumor engager induces potent tumor-dependent immune response without dose-limiting toxicity in preclinical studies. Journal for Immunotherapy of Cancer. 2021(9). http://dx.doi.org/10.1136/jitc-2021-SITC2021.702
3. Wenqing Jiang et al. Claudin18.2-4-1BB bispecific antibody induced potent tumor inhibition through tumor-specific 4-1BB activation. 2020 American Association for Cancer Research. DOI: 10.1158/1538-7445




















 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!

































 膜杰作
膜杰作 Star Staining
Star Staining