AD病理变化复杂多样,AD患者中普遍存在神经元丢失、突触障碍(如突触丢失和突出可塑性缺陷)、胞外淀粉样蛋白β (Aβ)沉积形成淀粉样斑块、异常磷酸化Tau蛋白形成胞内神经元纤维缠结。目前尚无法完全解释各种病理变化出现的原因,其发病机制也仍不明确。本文,小编梳理了AD发病机制的三大主流学说:
Aβ沉积形成淀粉样斑块是AD的主要病理特征之一。Aβ由淀粉样前体蛋白(amyloid precursor protein,APP)经分泌酶降解生成。APP降解共两种途径,主要有三种分泌酶参与,α- secretase,β- secretase(BACE)、γ- secretase。在淀粉样途径中,APP被BACE剪切产生sAPPβ蛋白,sAPPβ蛋白被γ- secretase继续剪切,生成Aβ多肽,包括Aβ1-42、Aβ1-40等,并释放到胞外,最终聚集形成淀粉样蛋白斑,导致AD发生。
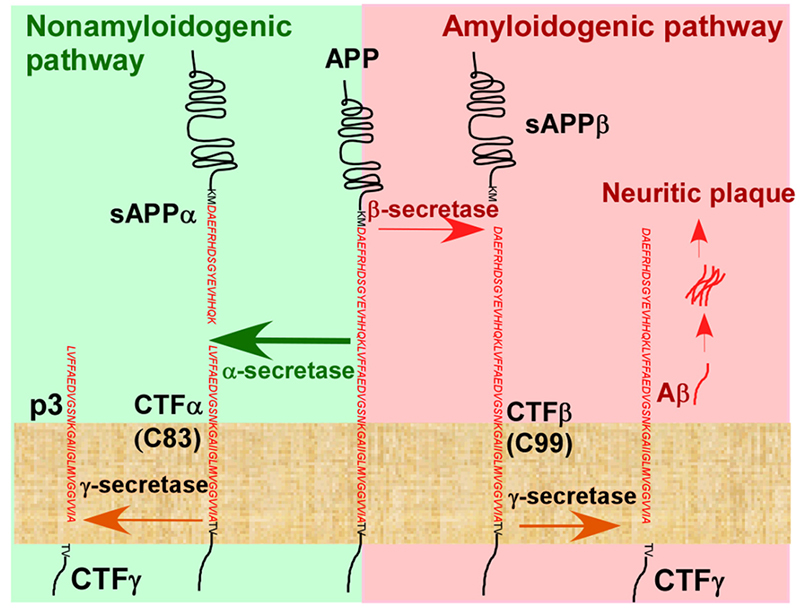
APP在体内水解途径
能够选择性结合以中和和消除可溶性、 有毒的Aβ淀粉样蛋白聚集体,被认为有助于AD中的神经退行性过程。基于该学说中关键靶点Aβ淀粉样蛋白,开发了多个药物:2021年6月7日,FDA批准Biogen的靶向Aβ的单抗药物Aducanumab上市。
靶向APP的单抗药物示意图
另外基于相同的作用机理和靶点,礼来的Donanemab、罗氏的Gantenerumab目前处于临床三期,卫材和渤健的Lecanemab获得FDA快速申请通道处于上市申请阶段。2022年2月7日,Fierce Pharma网站对2022年最受期待的新药上市进行了排名,其中Donanemab和Ganteneruma分别位列第一和第三。
神经元纤维缠结(neurofibrillary tangles,NFTs)的发生是AD患者的另一个主要病理特征。病理状态下,胞内Tau蛋白过度或异常磷酸化,使其丧失促微管组装的生物学活性,使微管解聚、轴突运转出现障碍,进而导致神经元变性,引起神经细胞的凋亡,造成AD的发生。
糖原合成激酶3β( the glycogen synthase kinase 3β,GSK-3β) 、细胞周期依赖型蛋白激酶5 ( cyclin-dependent kinase 5,CDK5) 、酪氨酸激酶在内的多种磷酸化激酶的高表达,是Tau蛋白异常磷酸化的关键因素,这些激酶被认为是治疗AD的潜在药物靶点。

Tau蛋白异常磷酸化
胆碱能学说是最早试图解释AD发病机制的学说。
早期Doucette等发现AD患者基底前脑Meynert基底核内胆碱能神经元严重丢失,这导致合成乙酰胆碱的乙酰胆碱转移酶(ChAT)活性降低,突触前胆碱能递质严重耗竭,从而导致认知功能下降。胆碱能学说认为胆碱酯酶,包括乙酰胆碱酯酶(AChE)、丁酰胆碱酯酶(BChE),活性下降的ChAT,是导致胆碱能水平下降的主要原因。
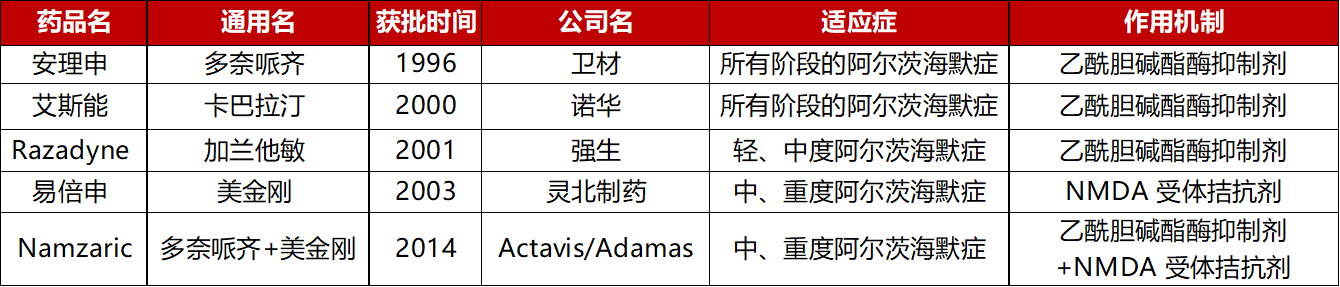
截止目前,FDA已批准多款治疗AD的胆碱酶抑制剂类药物,且仍作为治疗轻中度AD的临床一线药物不能从根本上治疗阿尔茨海默症,仅起到延缓疾病发生的作用,对阿尔茨海默症的治疗效果很有限。
获得 FDA 批准的治疗AD的胆碱酶抑制剂类药物
除了Aβ级联、Tau蛋白异常磷酸化、胆碱能三大主流学说,也有神经炎症反应、谷氨酸系统异常兴奋、线粒体功能紊乱等对AD发病机制的解释,科学界对AD的发病机制仍在持续探索中。
在近20年的时间内,除Aducanumab外,没有其他新药上市。随着全球老龄化形势日益严峻,亟待更多改善病情的治疗方法,继续开发相关药物。
ACROBiosystems开发了TAU蛋白TAU-441,淀粉样前体蛋白APP,β-分泌酶-1BACE1产品,高纯度经SDS-PAGE及SEC-MALS验证,助力AD治疗药物研发。
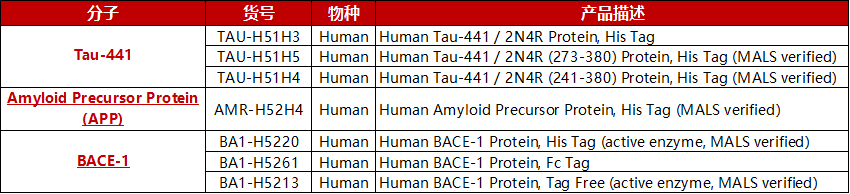
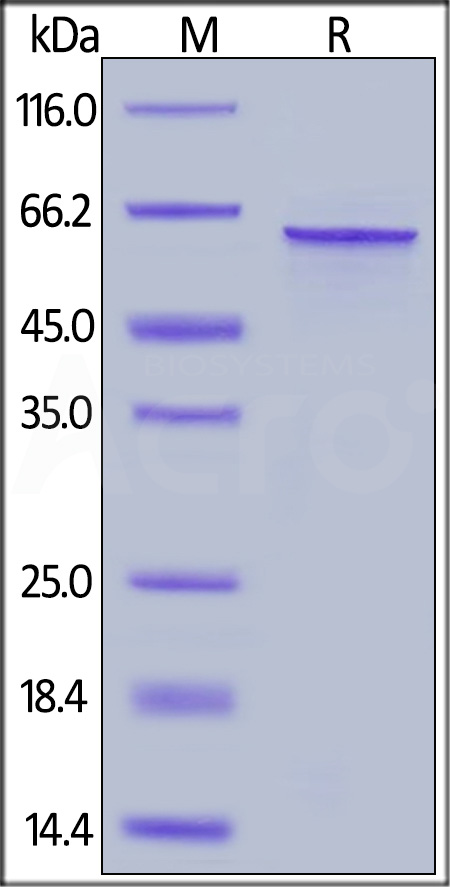
经SDS-PAGE验证,Human Tau-441 / 2N4R Protein, His Tag (Cat. No. TAU-H51H3) 纯度高于90%。
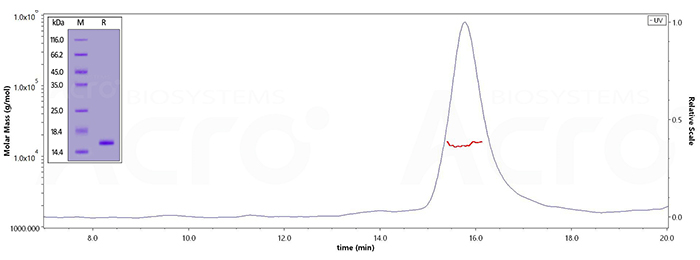
经SDS-PAGE验证,Human Tau-441 (273-380), His Tag (Cat. No. TAU-H51H5) 纯度高于95%;经SEC-MALS,纯度高于90%,分子量为12-18 kDa。
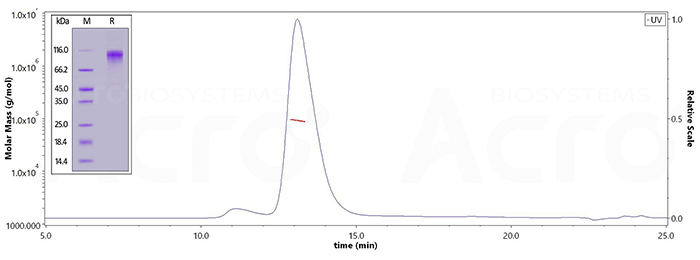
经SDS-PAGE验证,Human Amyloid Precursor, His Tag (Cat. No. AMR-H52H4) 纯度高于95%;经SEC-MALS,纯度高于95%,分子量为87-107kDa。

经SDS-PAGE验证,Human BACE-1, His Tag (Cat. No. BA1-H5220) 纯度高于95%;经SEC-MALS,纯度高于95%,分子量为55-65 kDa。
参考资料及文献
1、Ju Y, Tam KY. Pathological mechanisms and therapeutic strategies for Alzheimer's disease. Neural Regen Res. 2022 Mar;17(3):543-549. doi: 10.4103/1673-5374.320970.
2、Zhang X, Song W. The role of APP and BACE1 trafficking in APP processing and amyloid-β generation. Alzheimers Res Ther. 2013 Oct 8;5(5):46. doi: 10.1186/alzrt211.
3、Johnson GV, Stoothoff WH. Tau phosphorylation in neuronal cell function and dysfunction. J Cell Sci. 2004 Nov 15;117(Pt 24):5721-9. doi: 10.1242/jcs.01558.
4、药渡数据
5、证券研究报告






















 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!































 膜杰作
膜杰作 Star Staining
Star Staining


















