抗体偶联药物(antibody drug conjugates, ADCs)设计概念的拓展——借助靶向配体将治疗介质选择性地递送到疾病灶点处发挥治疗效果,催生偶联药物技术领域百花齐放的格局,形成“万物皆可偶联”的态势,在偶联药物领域逐渐发展出多种偶联形式与技术,其中包括:小分子偶联药物(SMDC)、多肽偶联药物(PDC)、抗体片段偶联药物(FDC)、抗体免疫刺激偶联药物(ISAC)、抗体细胞偶联药物(ACC)、病毒样药物偶联物(VDC)、抗体-降解子偶联物 (ADeC)等等,不仅能针对不同靶点和适应症进行快速开发,也有助于向各种新型偶联药物赛道上切换。接下来小编将为您逐一介绍这几种偶联技术。
与ADC 极为相似,小分子-药物偶联物 (Small molecule-drug conjugate, SMDC)由小分子靶向配体(与ADC区别最大的部分)、连接子和细胞毒分子(有效载荷)三个部分组成。小分子靶向配体使其容易渗透并能更均匀地扩散到肿瘤组织内部,同时不会在肿瘤及其他正常细胞中聚集,少数脱靶的药物也会被快速排出体外,从而减少对正常细胞的毒性,此外,相较于抗体药物,SMDC容易控制合成工艺和成本,工业化操作简单;SMDC理论上不会具有免疫原性,安全性控制更容易实现。
但与ADC相比,SMDC配体的选择是研发的一个难点,SMDC的小分子配体一直较难获得,主要是使用天然来源配体的衍生物,如靶向叶酸受体的叶酸衍生物、靶向前列腺特异性膜抗原的谷氨酸脲衍生物、靶向生长抑素受体的生长抑素类似物等。细胞毒分子则是SMDC的核心部分,其对于实现临床治疗价值至关重要。SMDC的适应症与ADC有较大区别,已上市ADC药物的适应症在实体瘤和血液瘤中均有分布,而SMDC的适应症主要集中于实体瘤。在实体瘤中,SMDC具有很好的细胞穿透性以及良好的体外和体内稳定性。
SMDC研发仍然在跌跌撞撞中前进,其相关研究尚未获得突破性进展。该项布局的企业数量以及靶点的丰富程度与ADC相差甚远。Endocyte和Tarveda是目前走在SMDC产品研发前沿的两家公司。国内赛生药业获得Tarveda的PEN866在大中华地区的开发和商业化许可,这一合作包括400万美元的预付款和总额高达7500万美元的开发、批准和商业销售里程碑付款。目前在SMDC中,处于临床研究阶段的产品有9个,适应症集中于实体瘤。这些产品除Vintafolide外,均处于早期研发阶段,其中进入Ⅱ期临床试验阶段的产品有3个,Ⅰ期的有5个,主要由Endocyte、Tarveda等研发,默沙东、诺华、BMS等全球制药巨头亦有所参与。
肽-药物偶联物 (Peptidedrug conjugate,PDC)是一种新型的偶联药物,由多肽、细胞毒素和连接体三个部分组成。PDC的出现可能克服ADC的某些局限性,弥补了传统小分子化学药的缺陷,能够实现药物的精准投递。其作用机理是当药物进入体内循环后,多肽识别肿瘤表面的抗原表位,肿瘤细胞将细胞毒素吞噬,在细胞内环境下,连接体脱落释放细胞毒素进而杀死肿瘤细胞。相比于ADC 药物,PDC 药物具有分子量小、肿瘤穿透性强、免疫原性低、利用固相合成法可大规模合成、生产成本较低、相对较好的药代动力学等特点。

结构图
目前全球领先活性多肽及PDC研发公司为英国双环肽公司Bicycle Therapeutics (NASDAQ:BCYC)和日本多肽研发公司PeptiDream Inc(TSE:4587)。国内相关的公司包括上海智肽生物、主流生物,泰尔康生物等。
目前只有两种PDC被FDA批准用于临床癌症治疗:Melflufen和177Lu-dotatate。Melflufen与地塞米松联合被批准用于治疗重度复发性或难治性多发性骨髓瘤(R/R MM)患者。FDA对Melflufen的加速批准是基于II期HORIZON研究的结果,该研究针对的是耐药和高危RRMM患者。到目前为止,这些PDC的结果好坏参半,这表明PDC的良好药效特性转化为改善患者临床结果方面仍存在一些挑战。
表1 全球热点PDC在研项目
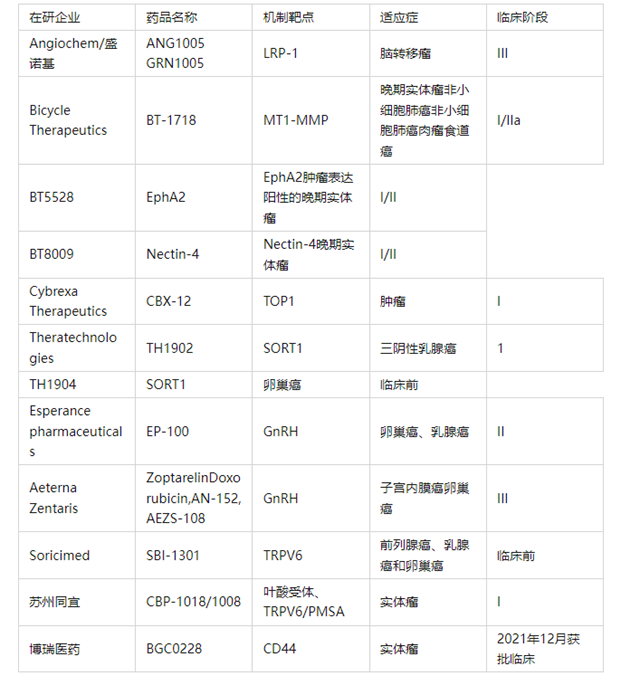
不同于ADC所用的完整单克隆抗体,FDC将抗体片段(单链scFv)与细胞毒性药物进行偶联。由于抗体片段分子量小,所以FDC的肿瘤穿透性更好。此外,FDC的半衰期也短于ADC,可以减少其在正常组织中的暴露,更好地控制毒副作用,且抗体片段相对容易发现,并且可以采用生物工程技术,实现更高的DAR值。
Antikor Biopharma公司率先开发了FDC。Antikor公司建立的OptiLink技术,可系统性地分析、改进抗体片段和毒素之间的连接物。通过改变连接物的化学结构和长短,以及在偶联药物上添加PEG聚合物,可以精准调控FDC的毒素/抗体片段负载比例(DAR)、成药性、药效和安全性。
来源:antikor网站
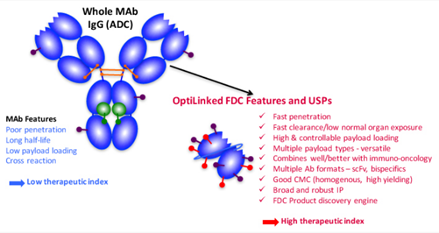
2020年12月,《自然-癌症》(Nature Cancer)发布的一篇文章中,来自美国Bolt Biotherapeutics公司和斯坦福大学医学院的研究人员报道了一种抗体免疫刺激偶联药物ISAC(Immune-stimulating Antibody Conjugate ,ISAC)。ISAC的技术要求与ADC非常类似,不同的是ISAC由抗体+连接子+激动剂三部分组成,不同于ADC正面打击敌人,那么ISAC就像是潜入肿瘤内部的间谍。可以将抗体靶向肿瘤的精确性、先天性和适应性免疫系统的杀伤潜力结合到单个药物中,在多种肿瘤模型中实现肿瘤完全消退和持久的抗肿瘤免疫,能够实现将冷肿瘤转化为免疫热肿瘤的能力。
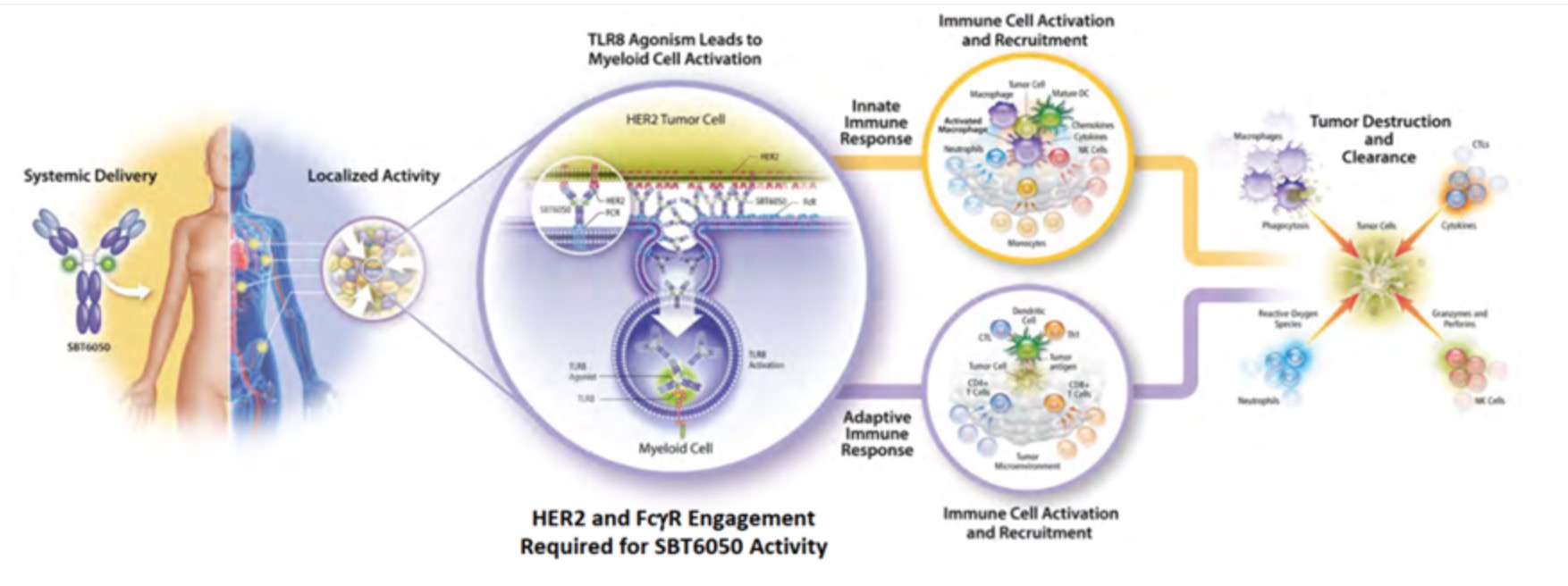 来源:AACR2021
来源:AACR2021
目前,涉及此类机制的药物主要包括Toll样受体激动剂(TLR)类ISAC药物SBT6050、SBT6290、BDC-1001;STING激动剂ISAC药物XMT-2056,Treg细胞调节ISAC药物ADCT-301等。总的来说,新型ISAC疗法具有强大的临床前抗肿瘤活性。代表性药物BDC-1001目前正在HER2表达肿瘤患者中进行Ⅱ期临床试验。
随着具有靶向定位作用的配体在临床上广泛应用(如ADC、PDC、SMDC),这些配体与放射性螯合物之间的结合也形成了一个新赛道——RDC。RDC主要由介导靶向定位作用的抗体或小分子(Ligand)、连接臂(Linker)、螯合物( Chelator)和放射/成像因子(放射性同位素,radioisotope)构成。运用抗体或小分子(包括多肽)的靶向作用来实现精确放疗的目的,对肿瘤进行高剂量杀伤的同时,降低对正常组织的辐射,从而减少副作用。
RDC与其他偶联药物之间最大的差异是药物载荷。RDC的载荷不再是毒性分子,而是放射性核素;由于放射性核素不需要与细胞直接接触,RDC的Linker在起效过程中不需要断裂,这进一步提高了RDC药物在体内的稳定性和安全性,将会是肿瘤诊断、成像以及治疗的新趋势新方法。
RDC药物可以根据配体类型的不同分为抗体靶向的核素抗体偶联药物(Radionuclide Antibody Conjugates,RAC)、基于小分子(包括多肽)的核素偶联药物等。
目前全球获批的RDC药物极少,而且处于临床研究阶段的项目也较少。在适应症上,RDC药物也主要集中在肿瘤领域,其治疗潜力仍然有待挖掘。
治疗用途的RDC目前只有诺华的Lutathera(177Lu-dotatate) 在美国、欧盟等地区获批上市,用于接受奥曲汀治疗进展后,且过表达生长抑素受体的胃肠胰腺神经内分泌肿瘤。
在临床研究中,Lutathera在与现有治疗方案奥曲汀的对比中表现除了显著的疗效提升:Lutathera与30mg奥曲汀联用,对比60mg奥曲汀,低肝脏肿瘤负担组中位PFS达到了28.35个月vs 11.04个月;高肝脏肿瘤负担组更是达到了中位PFS 19.38个月vs 5.52个月。在Lutathera之后,如今最令人期待的RDC产品当属177Lu-PSMA-617。2017年诺华斥资21亿美元通过收购Endocyte将其收入囊中。617的放射性同位素同样选择了Lu-177,Lu-177是目前RDC最常用的核素,配体则使用了靶向PSMA的小分子。2021年6月,诺华披露了617 Ⅲ期VISION研究的结果。
RDC可以与多种抗肿瘤药物协同,存在联合治疗增效的可能。随着国际制药巨头的加入和更多产品布局,RDC药物有望成为新的高速发展赛道。
病毒样药物偶联物(virus-like drug conjugates, VDC)是采用将病毒衣壳设计为非感染性蛋白质纳米颗粒(病毒样颗粒,VLP)作为高效递送载体的偶联药物形式。源自HPV的重组非感染性病毒样颗粒(VLP)能选择性与实体瘤细胞表面经修饰 的硫酸乙酰肝素蛋白聚糖(HSPG)结合,从而选择性递送光敏剂IRDye®700DX, 经红外光激活后杀伤肿瘤细胞,用于治疗脉络膜黑色素瘤。
Aura采用源自人乳头瘤病毒或HPV的VLP选择性地附着在修饰的硫酸乙酰肝素蛋白聚糖(HSPG)表面,实现与实体肿瘤细胞或转移灶结合,而不与正常组织结合的目的。AU-001正是这种机制的VDC产品,病毒样成分选择性地结合HSPG,偶联的红外光激活细胞毒药物被激活后,选择性破坏肿瘤细胞,导致肿瘤细胞急性坏死的同时激活免疫系统产生抗肿瘤应答。
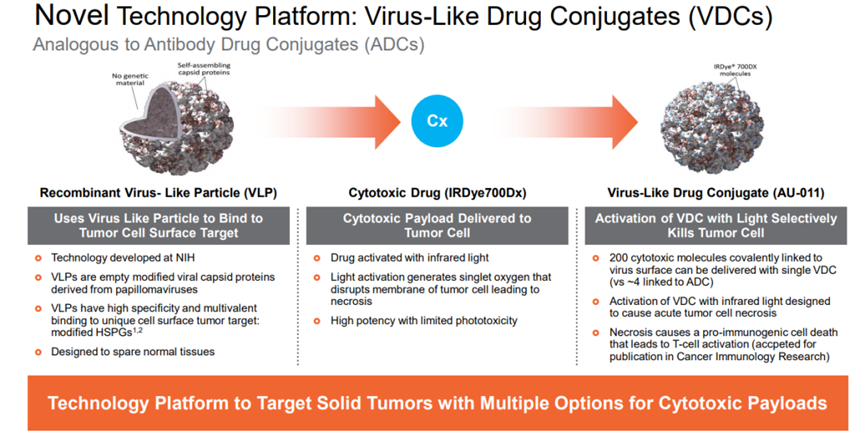
来源:Aura网站
2021年6月16日,瑞士公司Debiopharm和韩国Ubix Therapeutics联合宣布达成合作研究,将结合两家专有的技术平台Multilink™和Degraducer®开发抗体降解偶联药物(Antibody Degraducer Conjugates ,ADeC)。

这项合作刚刚开始,或许相关药物尚未展开研究。但是,基于双方的平台技术可以预测,将要开发的ADeC药物会是一款将载荷替换为降解分子的抗体偶联药物,或许也会同时携带其他载荷实现协同作用。ADeC目的也是将降解分子携带至靶位置,避免全身暴露,甚至克服一些Protac分子潜在成药性问题,如理化缺陷、特异性、PK等。
受创新浪潮的冲击和偶联药物更新迭代的影响,全球偶联药物研发热情高涨,除了上述介绍的偶联技术以及平台以外,还有比如:抗体-酶偶联物 (Antibody-enzyme conjugate,AEC);抗体-寡核苷酸偶联物 (Antibody-oligonucleotide conjugate,AOC);抗体新降解偶联药物(Antibody neoDegrader Conjugate,AnDC);抗体-生物聚合物偶联物(Antibody-biopolymer conjugate,ABC)等技术和平台。它们的产品设计理念延续了ADC药物思路,不同的是三类组成部分(配体-Linker-效应分子)的变换。不过,ADC、RDC、SMDC、ISAC仍然是目前最成功的偶联药物种类。由于篇幅限制不能对更多偶联药物技术平台进行细致分析。相信未来新型高效偶联药物将会不断涌现,并在人类与肿瘤等疾病的斗争中扮演更重要的角色。






















 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!

























 膜杰作
膜杰作 Star Staining
Star Staining









 来源:AACR2021
来源:AACR2021




