在免疫系统中,除了T细胞之外,自然杀伤(Natural Killer,NK)细胞也发挥了重要作用。尽管与CAR-T细胞疗法及其成熟的产品相比,NK细胞免疫疗法等都还属于研究试验阶段,目前国际上的研究人员认为,基于NK细胞的过继细胞疗法(ACT),包括基因修饰的CAR-NK细胞,比基于T细胞的疗法更安全。
在临床开发中,基于NK细胞的治疗策略还包括活化细胞因子的NK细胞,以及靶向NK细胞表面受体的抗体。
Siglecs 又称唾液酸结合免疫球蛋白样凝集素,是一种单次跨膜蛋白受体,大多数 Siglecs 作为跨膜受体发挥作用,主要以细胞类型特异性方式在血细胞上表达,优先在免疫细胞上表达并识别唾液酸化蛋白质、脂质和RNA。Siglecs大多是抑制性受体,如Siglec-2、Siglec-3、Siglec-5、Siglec-6、Siglec-7等。
Siglecs在先天免疫反应中发挥作用:研究表明Siglecs 参与免疫检查点的免疫信号传导,这些检查点能够调节炎症疾病和癌症中的免疫反应[1,2]。抑制性Siglecs 在其细胞内部在其胞内段C端具有免疫受体酪氨酸抑制基序 (ITIM),该部分被 Src 家族激酶磷酸化,磷酸化导致含有 Src 同源区 2 域的磷酸酶 (SHP)-1 和 SHP-2 产生高亲和力对接位点,参与附近酪氨酸磷酸化受体的去磷酸化进而抑制下游激活途径[2]。
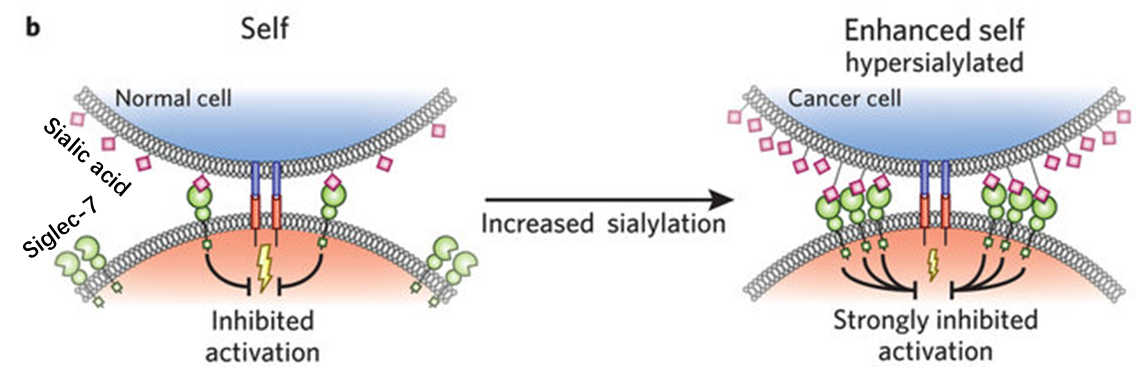
在抑制性Siglec中,Siglec-7和Siglec-9被报道在人类NK细胞上表达。Siglec-7是一种 CD33 相关的唾液酸结合 Ig 样凝集素,在NK细胞上强烈表达,唾液酸介导的Siglec-7募集抑制NK细胞活化;表征癌细胞的增强的唾液酸化可以通过Siglec-7和 Siglec-9 对NK细胞、骨髓细胞或 T 细胞影响,导致肿瘤逃避免疫监视,进而抑制抗肿瘤反应 (Fig. 1) [2,4] 。
Endogenous levels of sialic acids comprise self markers on normal cells,which may engageSiglec-7to aid in self recognition and suppress unwanted activation ofNKcells. (Left)Many cancer cells have higher levels of sialic acid (hypersialylated),which could recruit moreSiglec-7and provide a strong inhibitory signal to theNKcells and help in immune evasion. (Right)[4]
Siglec-7在离体扩增的NK细胞上以特别高的水平表达表明这其可能是涉及扩增NK细胞过继转移的治疗的潜在调节剂;NK细胞抑制的机制涉及Siglec-7重新分布到免疫突触,导致其磷酸化和磷酸酶Shp-1的募集,磷酸酶Shp-1通过激活受体减弱信号传导;这些作用是由Siglec-7与糖聚合物的相互作用介导的。
Siglec-唾液酸相互作用参与免疫耐受的调节。研究人员还发现在几种不同细胞系上酶促去除内源性唾液酸增加了它们激活NK细胞的能力: 天然Siglec-7配体被NK细胞用来抑制对“自身细胞”的激活,而癌细胞的高唾液酸化可能提供“增强的自身细胞”的特
征,使癌细胞可以利用天然抑制途径完成免疫逃避 (Fig. 2) [2,5] 。
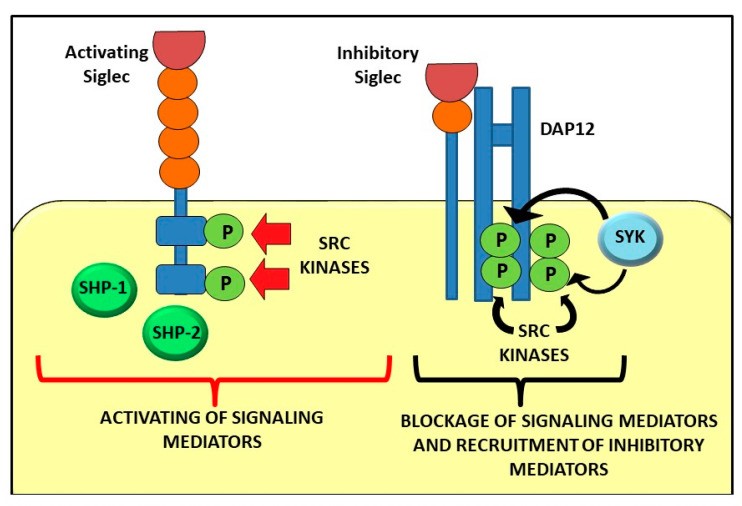
Figure 2 Signaling pathway mediated by activating and inhibitory Siglecs[2]
最新研究进展,研究人员通过监控多发性骨髓瘤 (multiple myeloma,MM ) 细胞和NK细胞上的Siglec配体和受体表达,证实了MM细胞可能利用Siglec-Siglec配体轴相关信号通路进行免疫逃避,科学家们通过功能验证得出结论: 肿瘤细胞的高唾液酸化有助于MM中NK细胞的免疫逃避,使用唾液酸酶或唾液酸转移酶抑制剂去唾液酸化是消除MM细胞上唾液酸和增强NK细胞介导的细胞毒性的有效策略;此外,去唾液酸化还可以恢复CD38在MM细胞上的表达,并最大化抗体 (如Daratumumab (anti-CD38) ) 依赖NK细胞介导的ADCC,并破坏抑制性Siglec-7-Siglec-7L 轴信号传导途径,从而增强NK细胞对 MM 细胞的清除。
这些数据支持了这样一种观点,即靶向癌细胞去唾液酸化或敲除NK细胞上的Siglec-7可能会增强过继性NK细胞疗法在癌症治疗效果[2,5]。
为助力NK细胞疗法优化或相关药物的开发,ACROBiosystems可为您提供一系列Siglec-7系列产品。
 产品特征
产品特征
- 纯度经SDS-PAGE验证,确定的均一的结构经SEC-MALS验证- 提供采用Avitag™单点酶标标记技术的生物素标记蛋白:生物素化发生在Avi标记的赖氨酸残基上,标记均一;不影响蛋白的天然活性- Fc标签产品包括Fc突变位点L117A, L118A 和L118A, G120A, E201A设计,可以显著降低ADCC效应,便于抗体筛选与功能评估- 与糖配体结合活性经ELISA/SPR等多平台验证
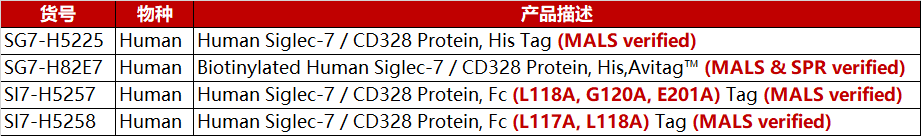
 产品列表
产品列表
 验证数据
验证数据
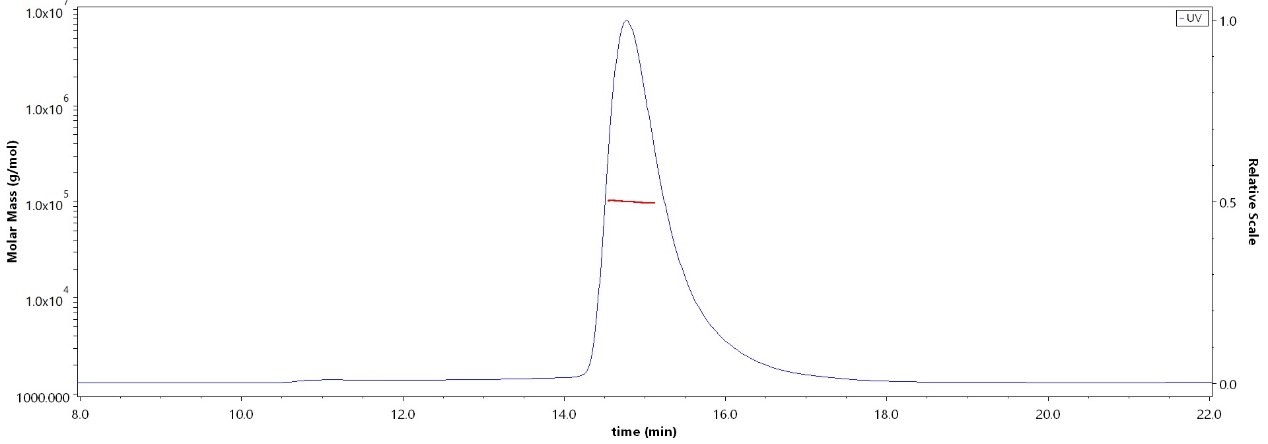
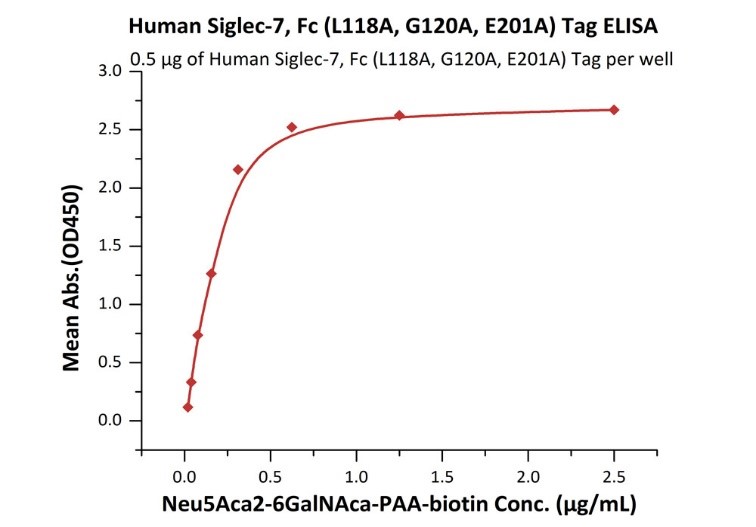
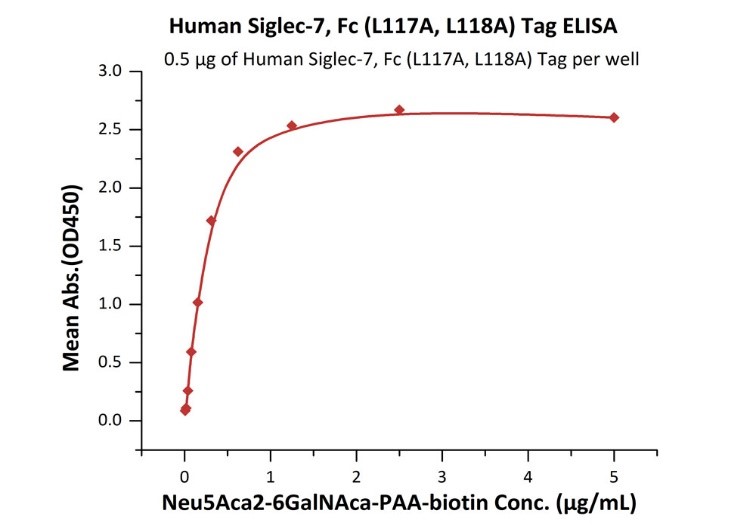
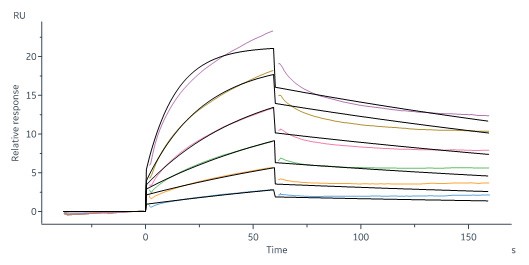
The purity of Biotinylated HumanSiglec-7,His,Avitag (Cat. No. SG7-H82E7) is more than 90% and the molecular weight of this protein is around 88-112 kDa verified by SEC-MALS.Immobilized HumanSiglec-7,Fc (L117A,L118A) Tag (Cat. No. SI7-H5257) at 5 μg/mL (100 μL/well) can bind Neu5Aca2-6GalNAca-PAA-biotin with a linear range of 0.01-0.625 μg/mL (QC tested).Immobilized HumanSiglec-7,Fc (L117A,L118A) Tag (Cat. No. SI7-H5258) at 5 μg/mL (100 μL/well) can bind Neu5Aca2-6GalNAca-PAA-biotin with a linear range of 0.01-0.625 μg/mL (QC tested).Biotinylated HumanSiglec-7,His,Avitag (Cat. No. SG7-H82E7) immobilized on CM5 Chip can bind Neu5Aca2-6GalNAca-PAA-biotin with an affinity constant of 29.2 nM as determined in a SPR assay (Biacore 8K) (QC tested).
参考文献
1. Lunemann JD,von Gunten S,Neumann H. Targeting sialylation to treat central nervous system diseases. Trends Pharmacol Sci. 2021;42(12):998-1008.
2. Gianchecchi E,Arena A,Fierabracci A. Sialic Acid-Siglec Axis in Human Immune Regulation,Involvement in Autoimmunity and Cancer and Potential Therapeutic Treatments. Int J Mol Sci. 2021;22(11).
3. Avril T,North SJ,Haslam SM,Willison HJ,Crocker PR. Probing the cis interactions of the inhibitory receptorSiglec-7with alpha2,8-disialylated ligands on natural killer cells and other leukocytes using glycan-specific antibodies and by analysis of alpha2,8-sialyltransferase gene expression. J Leukoc Biol. 2006;80(4):787-96.
4. Macauley MS,Paulson JC. Immunology: glyco-engineering 'super-self'. Nat Chem Biol. 2014;10(1):7-8.
5. Daly J,Sarkar S,Natoni A,Stark JC,Riley NM,Bertozzi CR,et al. Targeting hypersialylation in multiple myeloma represents a novel approach to enhanceNKcell-mediated tumor responses. Blood Adv. 2022.



























 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!


























 膜杰作
膜杰作 Star Staining
Star Staining