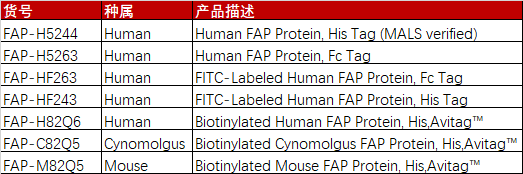
FAP在肿瘤微环境中的作用
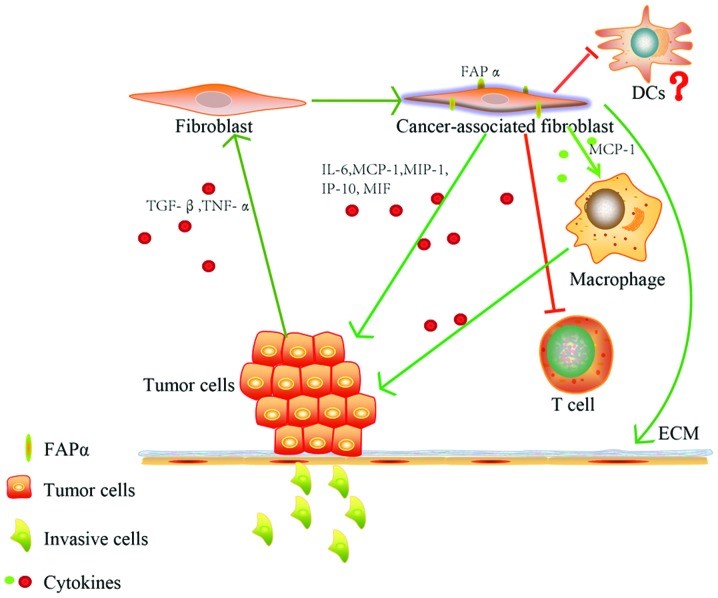
目前,实体瘤的治疗疗效依然不是很理想,对于肿瘤组织而言,就像一面铜墙铁壁,除了有肿瘤细胞以外,还包括由血管、成纤维细胞、胶原蛋白等构成的肿瘤基质,共同形成了肿瘤抑制微环境,其中TGF-β、TNF-α等细胞因子可刺激成纤维细胞活化为肿瘤相关成纤维细胞(CAF)并过表达成纤维活化蛋白(FAP),FAP可通过IL-6、MCP-1等细胞因子直接或间接促进肿瘤细胞的生长,另一方面,FAP还可以抑制T细胞的免疫功能,导致免疫无反应,并且FAP具有胶原酶和二肽酶的活性,通过参与肿瘤宿主界面基质的降解和重建,对肿瘤的浸润和转移具有重要意义[1](Fig 1)。
Fig1. Intricate interaction of tumor cells with FAPα in tumor microenvironment. [1]
为什么靶向FAP ?
FAP在CAF表面高度表达,而正常组织中不存在或表达较低。研究显示,在90%以上的上皮癌(包括乳腺癌、肺癌、结直肠癌等)中可发现FAP阳性CAF,所以FAP可作为理想的靶标来杀伤CAF而抑制肿瘤细胞的生长,并且破坏了肿瘤间质屏障,可以提高通过药物、放射疗法、细胞疗法为基础的治疗疗效,因此FAP成为研究实体瘤的重要靶点[2]。目前以 FAP 为靶点的肿瘤治疗策略主要有抗FAP单克隆抗体、靶向FAP的 CAR-T细胞疗法以及FAP介导的酶激活式抗肿瘤前体药物等,基本上均处于临床前研发阶段[2]。
FAP二聚体结构是关键
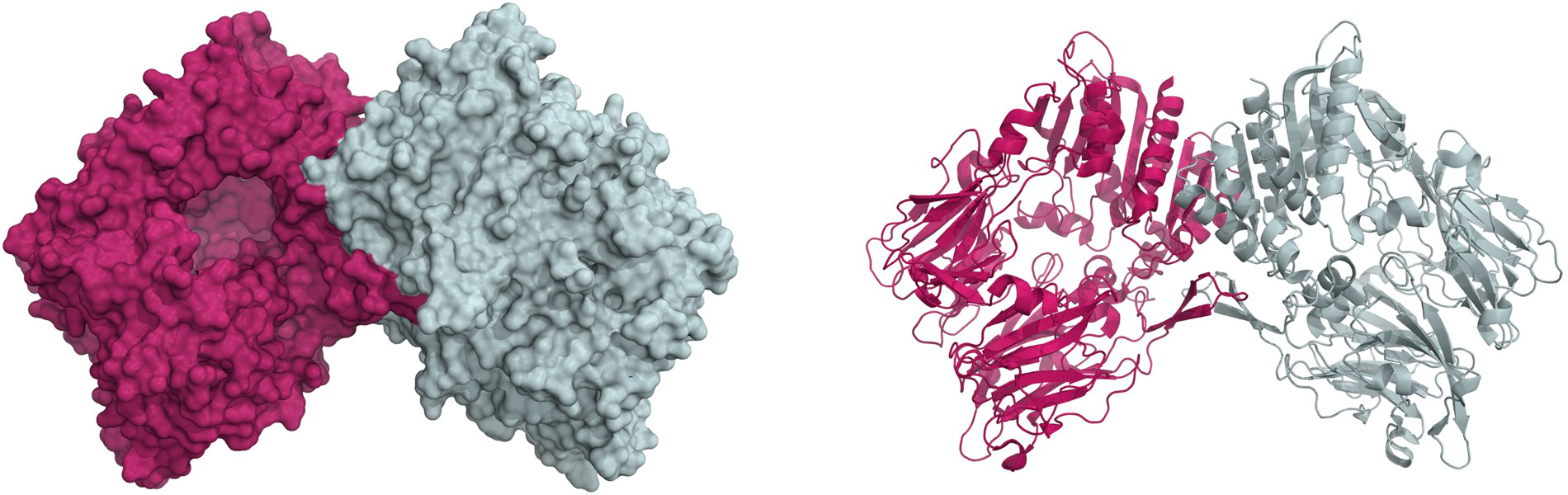
FAP蛋白是开发FAP相关药物的关键试剂,值得注意的是,FAP蛋白必须在天然二聚体的状态下才具有活性[3],因此高纯度的二聚体FAP蛋白是药物研发成功的重要保障(Fig 2)。ACROBiosystems开发了高生物活性的FAP蛋白,经SEC-MALS验证具有天然的二聚体结构,纯度大于95%,且酶催化活性大于8000pmol/min/µg,同时,经ELISA验证与Sibrotuzumab结合的线性范围为0.1-2ng/ mL,充分保证FAP蛋白的天然生物学活性,加速FAP相关药物的开发进程。
Fig 2. The crystal structure of the FAP homodimer. [3]
酶生物学活性大于8000pmol/min/µg
测定FAP将benzyloxycarbonyl-Gly-Pro-7-amido-4-methylcoumarin (Z-GP-AMC)催化为Z-Gly-Pro和AMC的活性,结果显示,酶生物学活性大于8000pmol/min/µg。
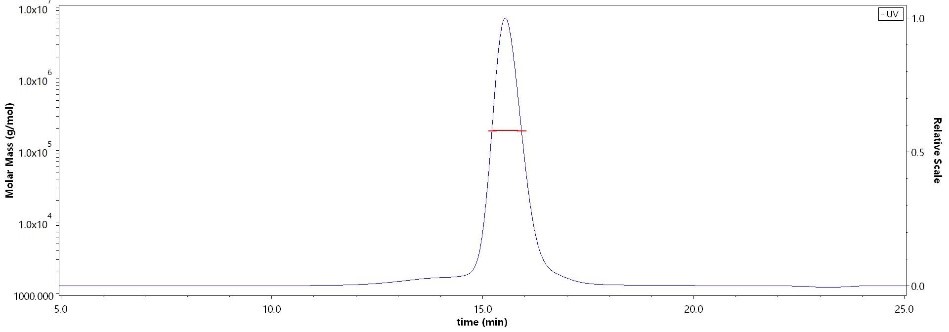
SEC-MALS验证天然二聚体形式大于95%
The purity of Human FAP, His Tag (MALS verified) (Cat. No.FAP-H5244) was more than 95% and the molecular weight of this protein is around 180-195 kDa verified by SEC-MALS.
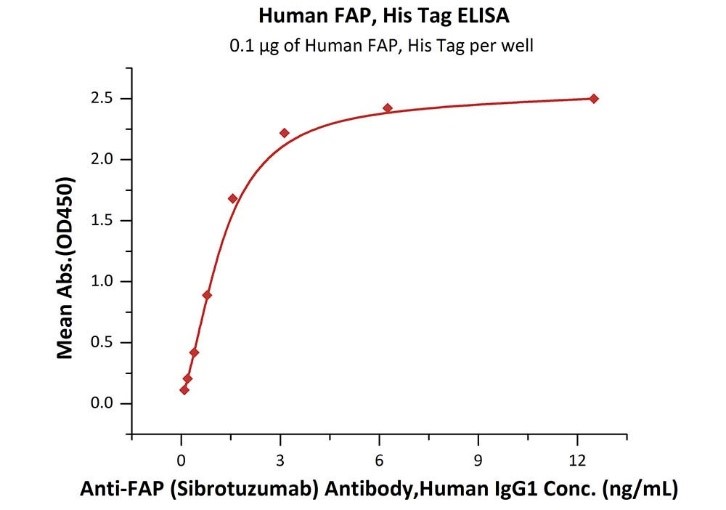
ELISA验证与Sibrotuzumab的结合活性,线性范围为0.1-2ng/mL
Immobilized Human FAP, His Tag (Cat. No.FAP-H5244) at 1 μg/mL (100 μL/well) can bind Anti-FAP (Sibrotuzumab) Antibody, Human IgG1 with a linear range of 0.1-2 ng/mL.
您可通过以下方式联系到ACROBiosystems:
邮件:order.cn@acrobiosystems.com
电话:13521050293
微信:扫描下方二维码即可进行沟通
(请备注公司+姓名)

更多CAR-T靶点蛋白系列产品:
> 全部CAR-T靶点蛋白产品
> CD19蛋白产品
> CD22蛋白产品
> MSLN蛋白产品
> 抗FMC63抗体产品
> FDA DMF备案蛋白
参考文献:
[1] Zi, Fuming et al. “Fibroblast activation protein α in tumor microenvironment: recent progression and implications (review).” Molecular medicine reports vol. 11,5 (2015): 3203-11.
[2] Hamson, Elizabeth J et al. “Understanding fibroblast activation protein (FAP): substrates, activities, expression and targeting for cancer therapy.” Proteomics. Clinical applications vol. 8,5-6 (2014): 454-63.
[3] Šimková, Adéla et al. “Molecular recognition of fibroblast activation protein for diagnostic and therapeutic applications.” Biochimica et biophysica acta. Proteins and proteomics vol. 1868,7 (2020): 140409.




















 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!

































 膜杰作
膜杰作 Star Staining
Star Staining