以CAR-T为代表的细胞免疫疗法,已在多种血液恶性肿瘤的治疗中表现出优秀的临床效果,然而主流的自体细胞疗法存在一些明显的关键性障碍,如成本高、大规模制造困难以及淋巴细胞减少症患者无法治疗等问题,因此,迫切需要可大规模生产的通用型现货细胞疗法产品。由于人类诱导多能干细胞(iPSCs)在特定培养条件下可分化为如T细胞、NK细胞、γδ-T细胞以及巨噬细胞等多种细胞类型,其独特的自我更新特性和可被基因工程编辑的能力,为细胞治疗提供了“无限供应”的平台。
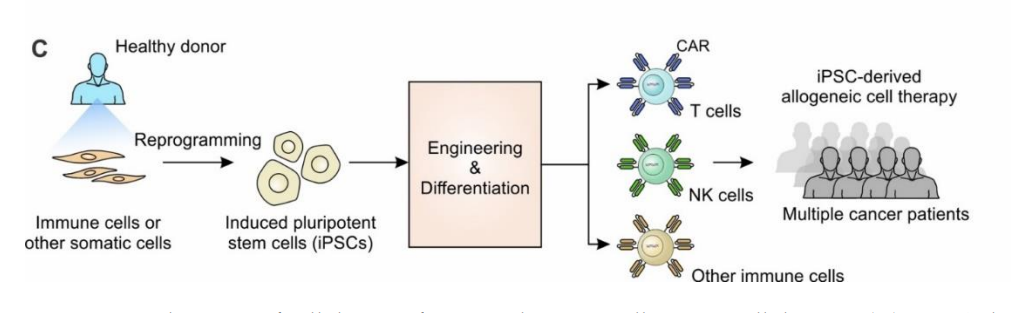
iPSCs来源的通用型细胞疗法,Cancers (Basel). 2022;14(9):2266
iPSCs诱导分化成T细胞涉及复杂的过程,经典方法是将来自健康供体的iPSCs与小鼠骨髓基质细胞系C3H10T1/2或OP9共培养,以产生CD34+的造血祖细胞(HE),然后HE被富集后与特定生长因子(如SCF、Flt3、IL-7、IL-3、TPO)和过表达DLL1或DLL4的OP9细胞系共培养,启动T细胞分化,最终得到iPSC诱导分化的T细胞。另外,也有基于3D类器官培养的iPSCs-T细胞分化方法,先将来自健康供体的人原代T细胞重新编辑为T-iPSC,继而在特定的细胞因子混合物中培养诱导为iPSC中胚层祖细胞(iMPs),然后,iMP在胸腺类器官 (ATO) 中与MS5-DLL4小鼠基质细胞系和细胞因子共培养以分化为T细胞。
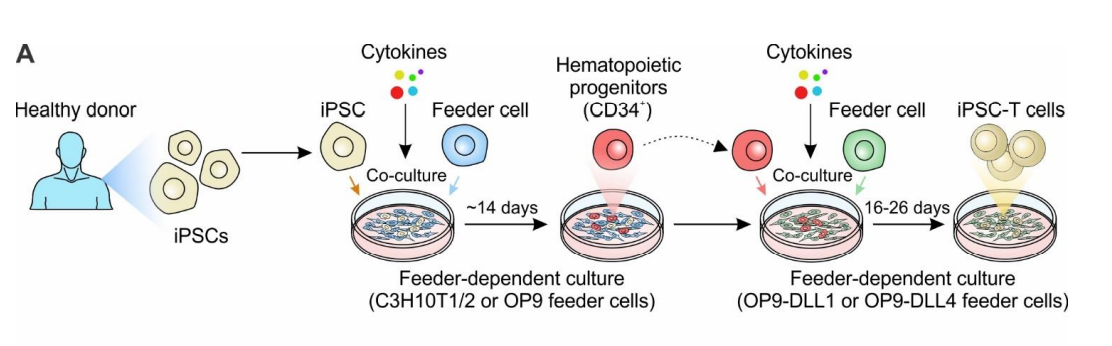
iPSCs诱导分化为T细胞的经典方法,Cancers (Basel). 2022;14(9):2266
iPSCs-NK细胞的分化方案最早来自人类胚胎干细胞-NK (hESC-NK)(在发现iPSCs之前,hESC是干细胞的主要来源),这也是一种依赖饲养层细胞的培养方法,需要将iPSCs与小鼠基质细胞系M210-B4共培养19-21天,诱导分化为造血干细胞 (HSC),然后分离出CD34+ CD45+造血祖细胞后,再与小鼠基质细胞系AFT024或EL08-1D2以及细胞因子混合物(包括IL-3、IL-7、IL-15、SCF和Flt-3L)共培养4-5周以产生分化为成熟的NK细胞。然而,从大规模制造的角度来看,使用鼠类来源的饲养细胞需要维持额外的成本,并增加了跨物种污染的风险,随后,研究人员开发了一种胚状体 (EB) 的无饲养层3D培养方法,iPSCs在无饲养层条件下生长一周后,转移到96 孔板中聚集在一起,形成大小均匀的胚状体EB,由于EB可形成自身的基质细胞来支持淋巴细胞的生长,从而消除对其他基质细胞系的需求。
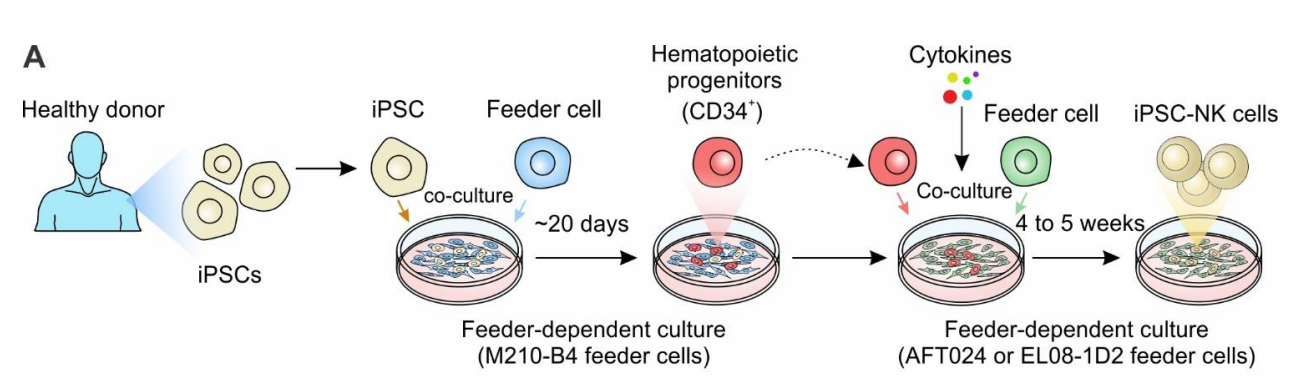
iPSCs诱导分化为NK细胞的基本流程,Cancers (Basel). 2022;14(9):2266
目前,已有多款基于iPSC来源的细胞疗法进入临床阶段,且取得了不错的治疗效果,2022年8月4日,哈佛医学院和波士顿儿童医院研究团队在Cell Stem Cell发表题为“EZH1 repression generates mature iPSC-derived CAR T cells with enhanced antitumor activity”的研究成果,表明通过组蛋白甲基转移酶(EZH1)抑制的表观遗传重塑,可使人类诱导多能干细胞(iPSCs)高效发育为成熟的T细胞,用于过继性细胞免疫治疗。另外,美国著名细胞治疗企业Fate Therapeutics,可对iPSC进行基因工程改造,筛选并保存单个iPSCs作为克隆主iPSCs系,基于该平台,Fate公司建立了广泛的现货型细胞疗法产品管线,其中包括iPSCs来源的CAR-T、CAR-NK以及NK细胞等疗法,正在血液肿瘤和实体瘤中进行探索。在国内,也有越来越多的企业如加科思、士泽生物、星奕昂生物、博生吉医药、北恒生物、百济神州等加入iPSCs领域,并取得了积极的进展,随着iPSCs技术的不断进步,iPSCs的关注度与日俱增,期待该领域取得更多突破,为患者带来更多的治疗选择。
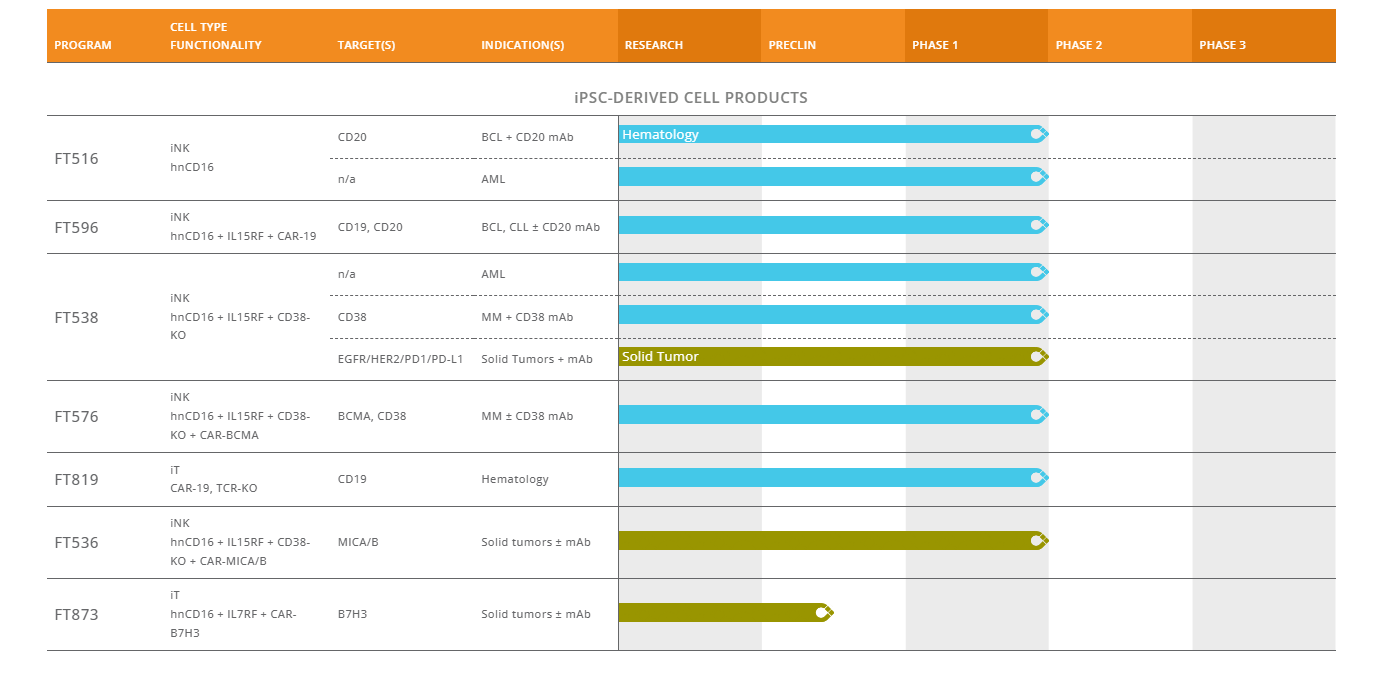
Fate Therapeutics研发管线(来源:Fate官网)
|
货号
|
产品名称
|
|
IL2-H5215
|
Human IL-2 Protein, premium grade
|
|
IL3-H5218
|
Human IL-3 Protein, premium grade
|
|
IL7-H4219
|
Human IL-7 Protein, premium grade
|
|
IL5-H4117
|
Human IL-15 Protein, premium grade
|
|
IL1-H5213
|
Human IL-21 Protein, premium grade
|
|
FLL-H5218
|
Human Flt-3 Ligand Protein, premium grade
|
|
THN-H5214
|
Human Thrombopoietin / TPO Protein, premium grade
|
|
SCF-H5219
|
Human SCF / KITLG (26-189) Protein, premium grade
|
|
VE5-H4210
|
Human VEGF165 Protein, premium grade
|
|
BFF-H4117
|
Human FGF basic Protein, premium grade
|
参考文献
1. Goldenson, Benjamin H et al. “iPSC-Derived Natural Killer Cell Therapies - Expansion and Targeting.” Frontiers in immunology vol. 13 841107. 3 Feb. 2022, doi:10.3389/fimmu.2022.841107
2. Zhou, Yang et al. “Engineering Induced Pluripotent Stem Cells for Cancer Immunotherapy.” Cancers vol. 14,9 2266. 1 May. 2022, doi:10.3390/cancers14092266
3. Heipertz, Erica L et al. “Current Perspectives on "Off-The-Shelf" Allogeneic NK and CAR-NK Cell Therapies.” Frontiers in immunology vol. 12 732135. 1 Dec. 2021, doi:10.3389/fimmu.2021.732135






















 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!































 膜杰作
膜杰作 Star Staining
Star Staining