免疫检查点抑制剂(Immune checkpoint blockade, ICB)为癌症治疗带来了一场革命,然而肿瘤内部的改变和外部环境因素会导致ICB耐药的出现且免疫单药治疗恶性肿瘤整体有效率为20%-30%。因此,科研工作者在探索更多的新型免疫治疗方法,让更多的患者从中获益。
PD-1/CTLA-4免疫双抗,分别作用于免疫的不同环节,具有不同效应,将给患者带来全新获益。CTLA-4主要作用于启动阶段,是抗原呈递阶段的主要影响因素。而PD-L1主要作用在效应阶段,阻断免疫检查点从而杀伤肿瘤。因此同时阻断CTLA-4和PD-L1可能会增强抗肿瘤作用。免疫治疗双抗(PD-1、CTLA-4)时代的序幕正在悄然拉开。
康宁杰瑞 PD-L1/CTLA-4 双抗 II 期最终临床结果发布,针对三阴乳腺癌
2022年12 月,康宁杰瑞在第 45 届圣安东尼奥乳腺癌研讨会(SABCS)上以焦点壁报讨论形式公布了 PD-L1/CTLA-4 双抗 KN046(该药采用机制不同的CTLA-4与PD-L1单域抗体融合组成;可靶向富集于PD-L1高表达的肿瘤微环境及清除抑制肿瘤免疫的Treg) 联合白蛋白结合型紫杉醇治疗晚期三阴乳腺癌患者的 Ⅰb/Ⅱ 期最终临床 KN046-203 研究数据。
KN046-203是一项 Ⅰb/Ⅱ 期、开放、多中心的临床研究,旨在评估 KN046 联合白蛋白结合型紫杉醇在晚期三阴乳腺癌受试者中的有效性、安全性和耐受性。研究共入组 27 例初治局部晚期不可切除或转移性三阴乳腺癌女性患者。KN046-203 的初步研究结果已于 2021 年在 AACR 大会线上公开,本次公开的数据是该研究的最终研究结果。研究结果表明:患者的客观缓解率(ORR)为44%,疾病控制率(DCR)为96%,KN046联合白蛋白结合型紫杉醇对晚期三阴性乳腺癌患者有效。
此外,康方生物自主研发的PD-1/CTLA-4双特异性抗体新药卡度尼利单抗注射液已获中国NMPA批准上市,用于治疗既往接受含铂化疗治疗失败的复发或转移性宫颈癌患者(R/M CC)。度尼利单抗单药就可以同时抑制PD-1、CTLA-4两条免疫信号检查点通路,激活免疫细胞强化抗肿瘤效应。
齐鲁制药公布PD-1/CTLA-4双抗2期临床数据,疾病控制率超93%!
2022年12月2日,在2022年欧洲肿瘤内科学会亚洲大会(ESMO ASIA)上,齐鲁制药公布了QL1706联合化疗+/-贝伐治疗晚期非小细胞肺癌(NSCLC)的II期临床研究结果,该实验旨在评估其治疗晚期NSCLC患者的效果和安全性,研究对象为表皮生长因子受体(EGFR)野生型和EGFR突变型的晚期NSCLC患者。数据显示:QL1706在包括非小细胞肺癌患者在内的晚期实体瘤患者中显示出了良好的抗肿瘤疗效。在EGFR野生型的晚期NSCLC患者中,患者的疾病控制率(DCR)达到了93.1%;在EGFR突变型的晚期NSCLC患者中,DCR达到了93.5%。
QL1706是齐鲁基于MabPair 抗体平台自主开发的一种新型靶向PD-1 IgG4和CTLA-4 IgG1的双靶点的抗体药物,可同时阻断PD-1和CTLA-4两个靶点。该药实际上为PD-1和CTLA-4的联合用药。Mabpair抗体专利平台主要是利用同种电荷相互排斥的原理,通过对电荷的改造防止两个抗体的重链和轻链的错配,从而实现在同一个哺乳动物细胞中生产两种完全不同的单克隆抗体。
总体上,QL1706联合化疗显示出良好、可控的安全性特征,其安全谱与化疗或抗PD-1联合抗CTLA-4治疗的报告一致。
阿斯利康PD-1/CTLA-4双抗在国内申报临床!一线治疗非鳞状非小细胞肺癌!
2022年11月5日,中国国家药监局药品审评中心(CDE)网站显示,阿斯利康的PD-1/CTLA-4双抗MEDI5752的临床试验申请已获受理。
MEDI5752是一种由CTLA-4单抗Tremelimumab与一种PD-1单抗组合而成的单价双抗,相比二价双抗不会引起受体同二聚化,靶向性更强。Tremelimumab已于今年10月获FDA批准上市,用于与度伐利尤单抗联用一线治疗肝癌。MEDI5752的Fc结构域经过改造以携带L234F、L235E和P331S突变,旨在消除抗体的ADCC等效应。临床前研究表明,MED15752不仅能够介导CTLA-4的内吞,而且能够介导PD-1的内吞和降解(依赖于CTLA-4的表达),这是其它PD-1相关抗体没有的功能。
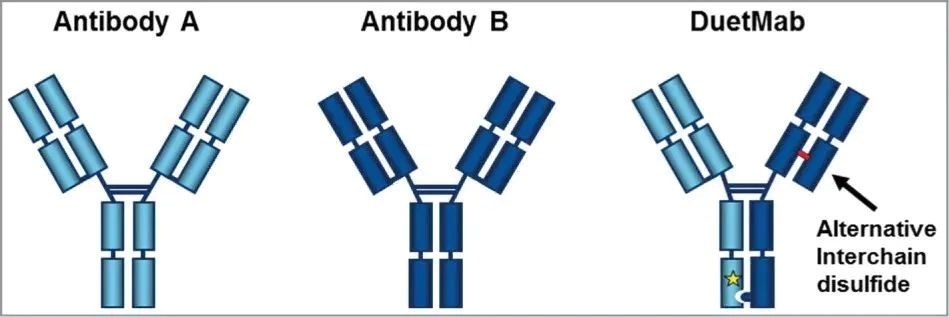
DuetMab技术平台的原理 (数据来源于MAbs)
该产品的临床试验结果先后在今年美国癌症研究协会(AACR)年会、美国临床肿瘤学会(ASCO)年会、欧洲肿瘤内科学会(ESMO)年会上公布。在ESMO会议上公布的MEDI5752一线治疗非鳞状非小细胞肺癌患者的Ib/II期最新研究结果表明,MEDI5752+化疗(M1500+C)组的客观缓解率为50.0%,中位无进展生存期为15.1个月;帕博利珠单抗+化疗(P+C)组的客观缓解率为47.6%,中位无进展生存期为8.9个月。
截至目前,全球仅1款PD-1/CTLA-4双抗上市,即康方生物的卡度尼利单抗;1款双抗产品(PSB205,齐鲁制药)已进入III期临床阶段。此外,默克的联合疗法(帕博利珠单抗+quavonlimab)也已进入III期临床阶段。
ACROBiosystems百普赛斯已针对PD-(L)1及CTLA-4开发了不同种属、不同标签的产品,蛋白均一结构及高纯度经MALS验证;高生物活性经ELISA/SPR/BLI/FACS等多平台验证;适用于免疫、抗体筛选、SPR、细胞活性检测等实验。
✍ CTLA-4二聚体结构经SELC-MALS验证
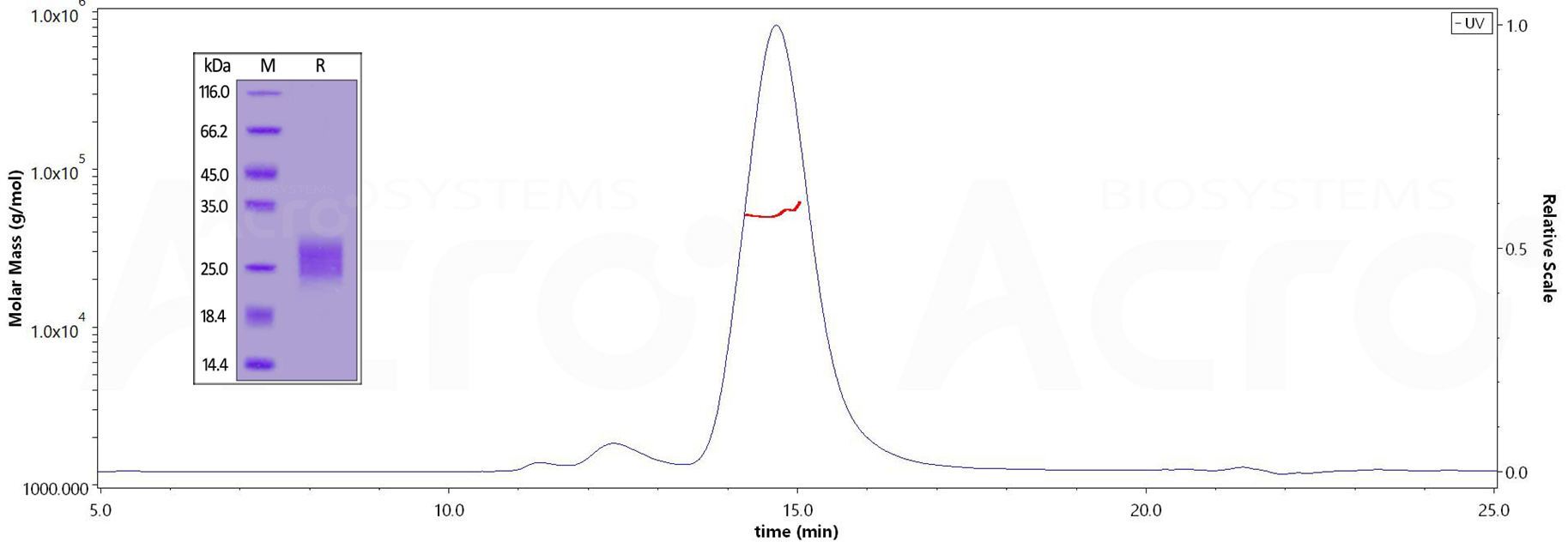
经还原条件下SDS-PAGE验证,人CTLA-4蛋白, His Tag (Cat. No. CT4-H52H9)纯度高于90%;经SEC-MALS验证,人CTLA-4, His Tag (Cat. No. CT4-H52H9)纯度高于90%,分子量为45-60kDa。
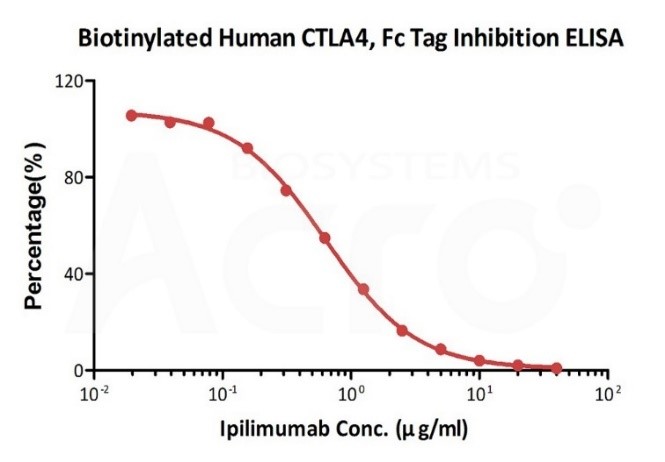
经SPR验证,固定在CAP-S系列传感器芯片上的生物素化人 CTLA-4蛋白, His,Avitag (Cat. No. CT4-H82E3)可以与Yervoy (Ipilimumab)结合,亲和力常数为0.635 nM (Biacore T200)。
✍ CTLA-4抗体中和了B7-2与CTLA-4的结合
将Ipilimumab(CTLA-4单抗)中和抗体的连续稀释液(1:2的连续稀释液,从40μg/mL到0.019μg/mL)加入到人B7-1, Fc Tag (Cat. No. B71-H5259): 生物素化人CTLA-4, Fc,Avitag (Cat. No. CT4-H82F3)结合的反应体系中。
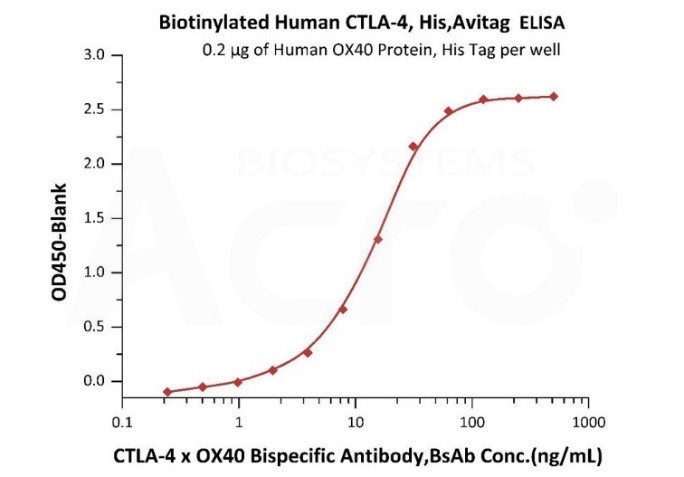
✍ 通过完整的检测方法对人血清中的CTLA-4 x OX40双特异性抗体进行定量分析
固定2 μg/mL 人OX40, His Tag (MALS verified) (Cat. No. OX0-H5224),在50%的人血清中加入浓度逐渐增加的CTLA-4 x OX40双特异性抗体,然后加入0.2 μg/mL的生物素化人CTLA-4, His, Avitag (Cat. No. CT4-H82E3)。使用HRP结合的链霉亲和素进行检测,灵敏度为4 ng/mL。




















 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!

































 膜杰作
膜杰作 Star Staining
Star Staining