脱氧核糖核酸酶(DNase)和核糖核酸酶(RNase)是一类可以将聚核苷酸链的磷酸二酯键切断从而降解DNA和RNA分子的水解酶。核酸酶通常具有极强的活性,微量的DNase /RNase污染可以造成大量DNA/RNA的降解,对实验和生产工艺造成显著影响。
核酸酶广泛存在于环境、物料和耗材表面,在一些如离心管、96孔板、移液器枪头等生物材料中更是以相对较高的浓度存在,常见的分子生物学试剂,如反应缓冲液、RNA/DNA纯化和储存的缓冲液、逆转录酶和RNA聚合酶等工具酶中同样存在RNase/DNase污染问题。
生物制品生产过程中,也大量存在核酸酶的残留和污染的可能性,包括生物样品中含有的内源性RNase污染,存在于环境中的水,缓冲液,耗材表面以及环境微生物和人等外源性污染。此外,部分生物制品生产过程中会额外使用核酸酶,因而有很大可能造成核酸酶的残留。残留核酸酶作为杂质,如果跟随生物制品进入人体内,有可能引发高强度的免疫原性等反应,引起较严重的安全性风险。因此需要对核酸酶的残留进行准确的分析检测,使之控制在安全范围内,成为生物制品生产质控的关注点之一。
重磅新品:基于荧光探针法的DNase/RNase残留活性检测试剂盒
因此,对于这样一个在药物研发及生产各个环节都有可能引入且会对生物制品安全性造成严重影响的常见杂质,需要在药物研发和生产过程中进行严格的质量控制及评估。
随着生物医药行业近年来的蓬勃发展,越来越多的生物制品被用于疾病的预防与治疗等,mRNA技术、细胞与基因治疗领域、基于病毒载体改造的疫苗等技术逐渐被广泛使用。在对新技术的惊人效果充满期待的同时,市场对于生物制品类产品的质量和安全性也提出了更高的要求,许多相关法规政策陆续推出以保证生物制品安全性与对杂质残留的控制。《中华人民共和国药典2020年版》中就《人用疫苗总论》、《人用重组单克隆抗体制品总论》、《人用基因治疗制品总论》及《细胞治疗产品研究与评价技术指导原则》分别提到了在该类型生物制品的研发及生产过程中需要对工艺相关杂质进行控制,包括核酸酶。
《人用疫苗总论》:对于与疫苗关键质量属性相关的工艺杂质(如细胞基质残留蛋白质和细胞基质残留DNA,抗生素、核酸酶、残余牛血清等),如因产品特性无法在成品中检测时,应在适当的中间产物(如原液或半成品)取样检测,其检测结果应能准确反映每一残留水平。
《人用重组单克隆抗体制品总论》:对于与重组单克隆抗体制品相关的工艺杂质采用适宜的方法对供试品宿主蛋白质、宿主细胞和载体DNA、蛋白A及其他工艺相关杂质进行检测。供试品在规定的范围内。其中,其他工艺相关杂质检测包括RNase/DNase残留。
《人用基因治疗制品总论》:对于基因治疗制品工艺相关杂质,应检测细胞来源的污染物的残留水平,例如来自包装细胞系或细菌的宿主细胞蛋白和宿主细胞DNA 。对于生产中使用了辅助病毒、质粒DNA 、牛血清、核酸酶、抗生素等的制品,还应分别检测其残留量或残留活性。
《体内基因治疗产品药学研究与评价技术指导原则(试行)》:对于核酸类产品,DNA类核酸的稳定性相对较好,但剧烈的环境条件和核酸酶暴露仍有可能对DNA的高级结构、完整性产生破坏。RNA类核酸稳定性较差,且对RNA酶较为敏感,其生产和贮存应处于严格的无RNA酶的环境。
《体外基因治疗产品药学研究与评价技术指导原则(试行)》:慢病毒载体的纯化工艺通常采用核酸内切酶去除附在病毒载体表面的大片段核酸杂质,所以要对核酸酶残留、BSA残留等杂质的去除率进行研究。应有效清除至低于质量标准范围或经过验证研究的水平。
《免疫细胞治疗产品药学研究与评价技术指导原则(试行)》:免疫细胞治疗产品相关杂质包括残留的蛋白酶、诱导试剂、血清等,需采用适用的方法进行研究。其中,残留的蛋白酶包括RNase/DNase残留。
目前,核酸水解凝胶电泳法和紫外分光光度计法常被用于检测DNase和RNase的残留。然而核酸水解凝胶电泳法受实验人员的主观判断影响较大,无法准确定量,且操作时间长,测定通量较低。核酸水解紫外分光光度法定量限仅为0.01U/μL,不适合微量核酸酶残留的活性检测。HPLC法和电化学法则受限于仪器设备。相比之下,荧光探针法灵敏度高、检测速度快且能实现核酸酶活性的定量检测,因此被认为是核酸酶残留活性检测的最佳选择之一。
ACROBiosystems 百普赛斯经过严格的方法学验证,自主研发基于荧光探针法的DNase及RNase残留检测试剂盒,可用于判断环境、耗材、原料等是否存在DNase和RNase污染,检测生物制品中的DNase和RNase残留量,从而制定相应的清除方案以满足研发与生产的需求。
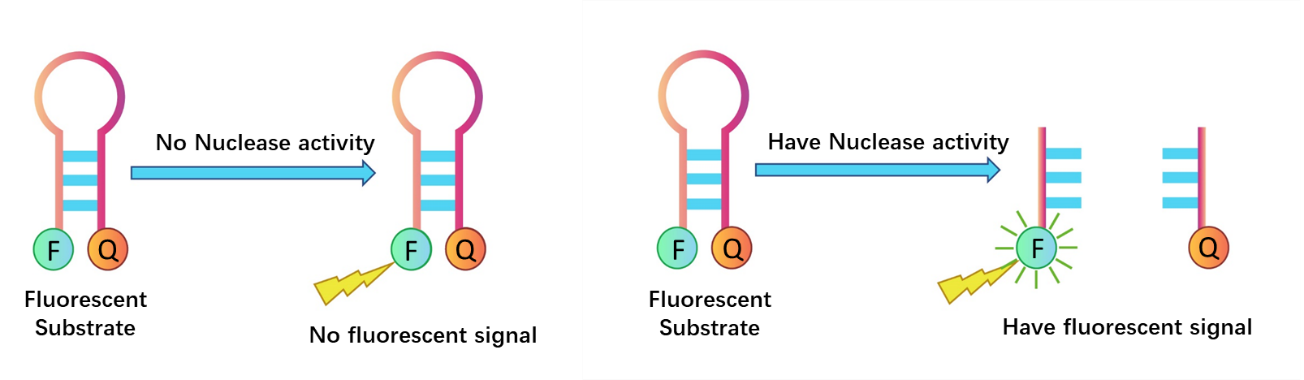
基于荧光探针法的DNase及RNase残留活性检测有赖于荧光团标记的RNA和DNA底物。当样品中不含RNase和DNase活性时,底物稳定,荧光基团和淬灭基团距离较近,由于荧光共振能量转移原理,不产生荧光信号;当样品含有RNase和DNase活性时,底物降解,荧光基团和淬灭基团相互远离,从而产生逐渐增强的荧光信号;荧光信号的增加速率与酶的数量和活性呈正相关。通过使用荧光微板读取器在ex/em=490/520nm(RNase), 535/565(DNase)的波长下测量可以确定样品是否有DNase/RNase污染。
★ 基于酶活性原理设计,适用于多种RNase或DNase的残留检测;
★ 灵敏度高,最低检出限低至3.9*10-5U(DNase)/0.03pg(RNase);
★ 严格质控,灵敏度、批间/批内差、准确度、冻融稳定性等保障;
★ 全面的方法验证,符合ICH Q2(R2)指导原则;
★ 使用简单快捷,30min内即可完成80+样本检测;
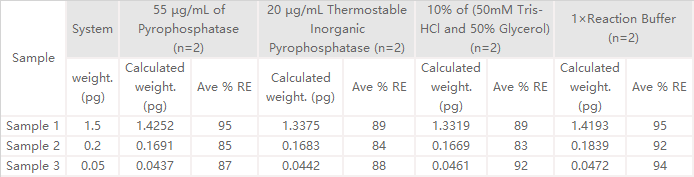
★ 回收率经验证,排除原酶中甘油稳定剂干扰;
★ 可联合使用,同时检测RNase或DNase残留无干扰。
|
Cat. No.
|
Product description
|
Sensitivity
|
Recovery
|
|
ASE-A001
|
RNase Activity Assay Kit (Fluorescence)
|
0.03125pg
|
80%-120%
|
|
ASE-A002
|
DNase Activity Assay Kit (Fluorescence)
|
3.90625*10-5U
|
80%-120%
|
判定标准:酶标仪法—待测品与阴性对照品的荧光比值<2,则判定为无DNase/RNase残留,否则有残留。
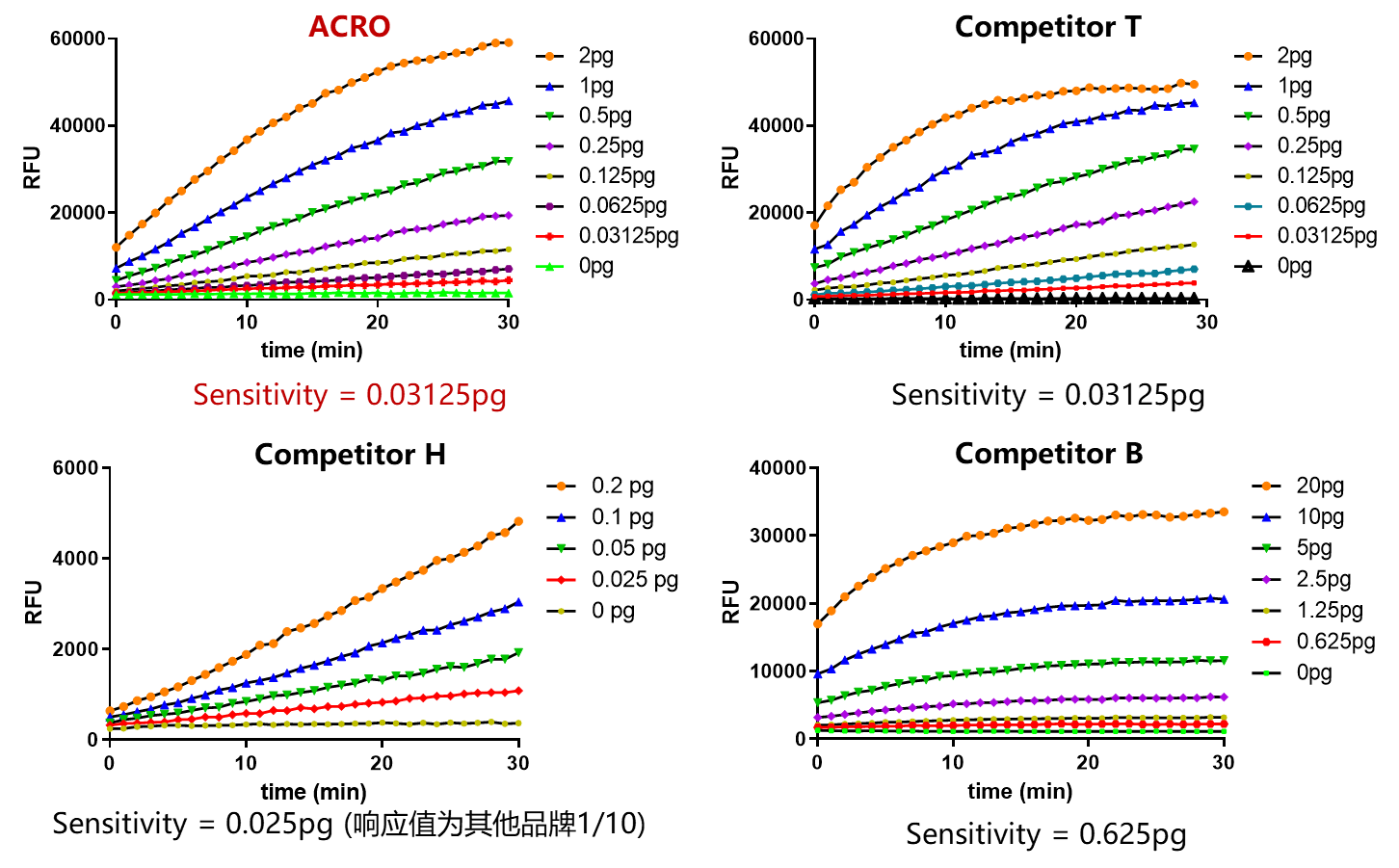
RNase Activity Assay Kit (Fluorescence)(ASE-A001)
✍ 经验证,该试剂灵敏度可达0.03125pg,与进口品牌Competitor T性能相近,优于市面上绝大多数其他品牌产品。
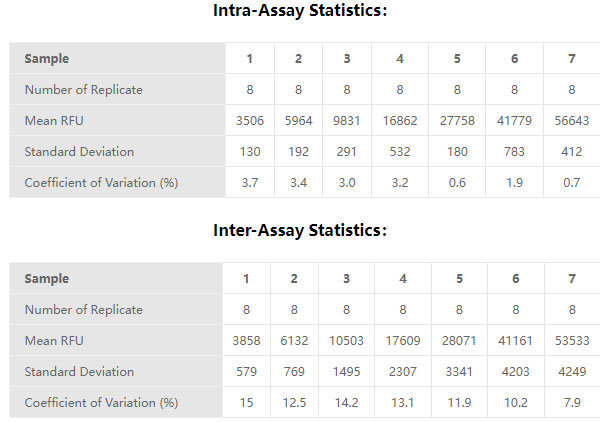
✍ 经验证,RNase Activity Assay Kit (Fluorescence)(Cat. No. ASE-A001)批内差≤10%,批间差≤15%,精密度符合标准。
✍ 经验证,RNase Activity Assay Kit (Fluorescence)(Cat. No. ASE-A001)回收率在80%~120%范围以内
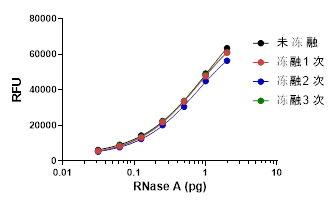
✍ 探针冻融3次,测试性能符合要求,灵敏度无降低,CV<10%
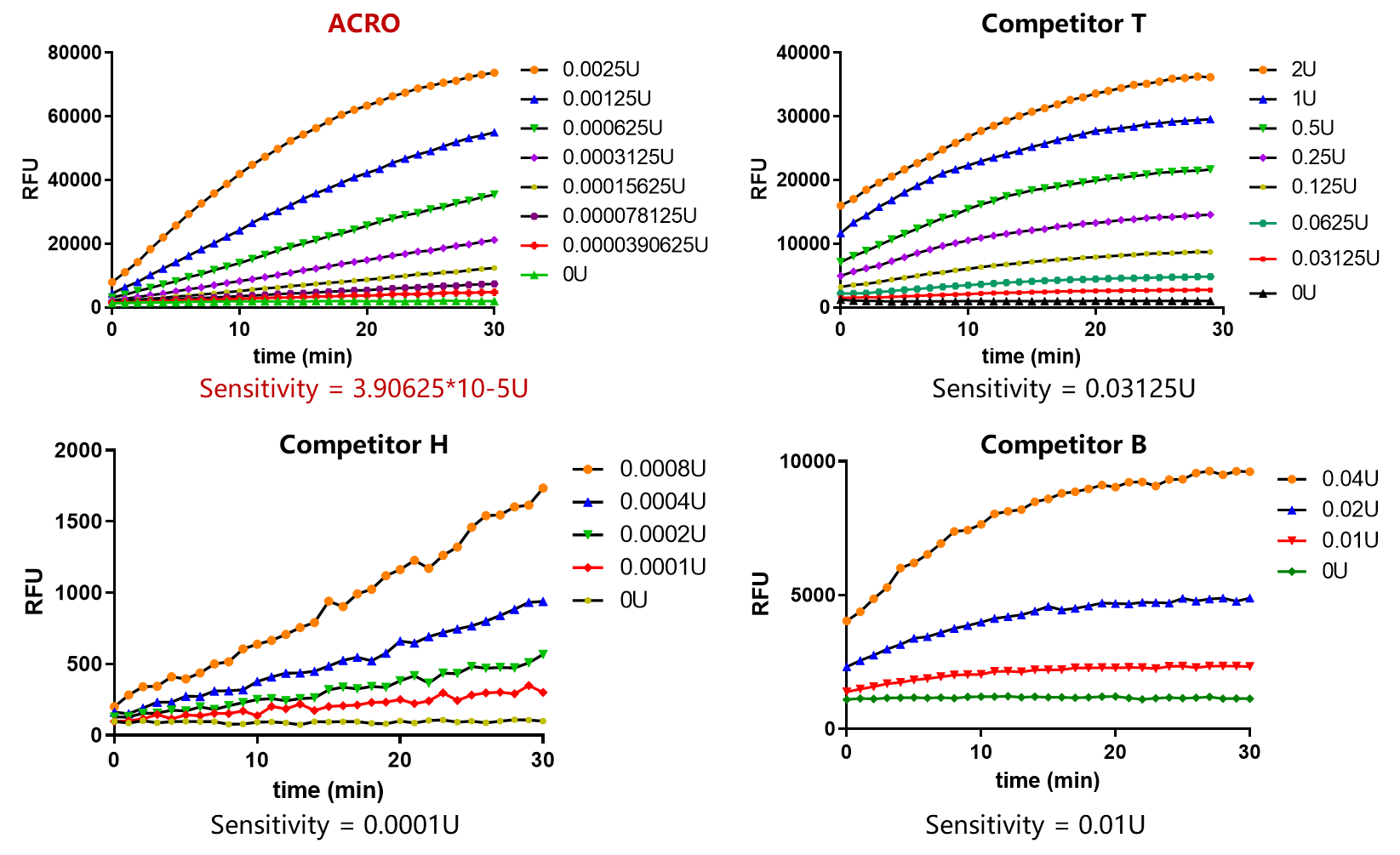
DNase Activity Assay Kit (Fluorescence)(ASE-A002)
✍ 经验证,该试剂灵敏度可达3.90625*10-5U,优于市面上绝大多数其他品牌产品。
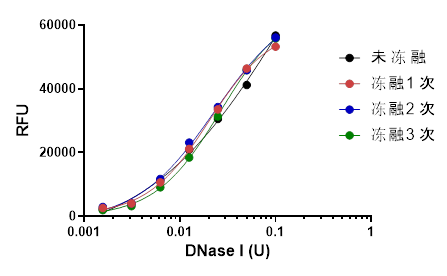
✍ 探针冻融3次,测试性能符合要求,灵敏度无降低,CV<10%
✍ 经验证,使用DNase Activity Assay Kit (Fluorescence)(Cat. No. ASE-A002)和RNase Activity Assay Kit (Fluorescence)(Cat. No. ASE-A001)检测同一样本核酸酶残留情况,无交叉干扰。
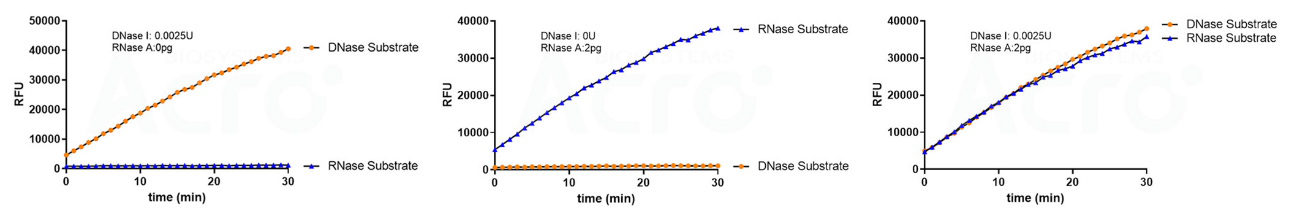
点击图片查看更多产品验证数据























 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!

























 膜杰作
膜杰作 Star Staining
Star Staining