帕金森病(PD) 是一种神经退行性疾病,也是最常见的运动障碍。由于病因病理生理尚未完全阐明,目前PD的治疗方案主要是对症治疗。打造PD体外和体内模型,是阐明病理学的重要工具,可以为疾病进展、细胞机制等提供新的见解。
对于PD模型,6-OHDA和MPTP等毒素诱导小鼠模型是经典的模型选择,应用广泛。通过将神经毒素引入动物模型,PD相关区域的多巴胺能神经元的快速退化导致了强大的和特征明确的运动缺陷。然而,神经退行性疾病的一个标志是蛋白质错误折叠和蛋白质聚集,导致细胞功能障碍、突触连接丧失和脑损伤。该模型仅模拟了PD的临床症状,缺乏α-突触核蛋白(α-Syn)堆积、路易体等分子病理学特征。
另一方面,SNCA、LRRK2、Parkin、PINK1和DJ-1基因突变的转基因小鼠也被用于研究PD。这些基因突变与PD的遗传形式有关,并表达相关的蛋白质。然而,这些转基因小鼠模型通常缺乏与毒素诱导模型相同的健壮的黑质纹状体退化(多巴胺神经元的损失),并且不具有相同的、一致的、可重复的运动缺陷。因此,毒素诱导和基因突变技术往往不能完全再现疾病的自然进展。
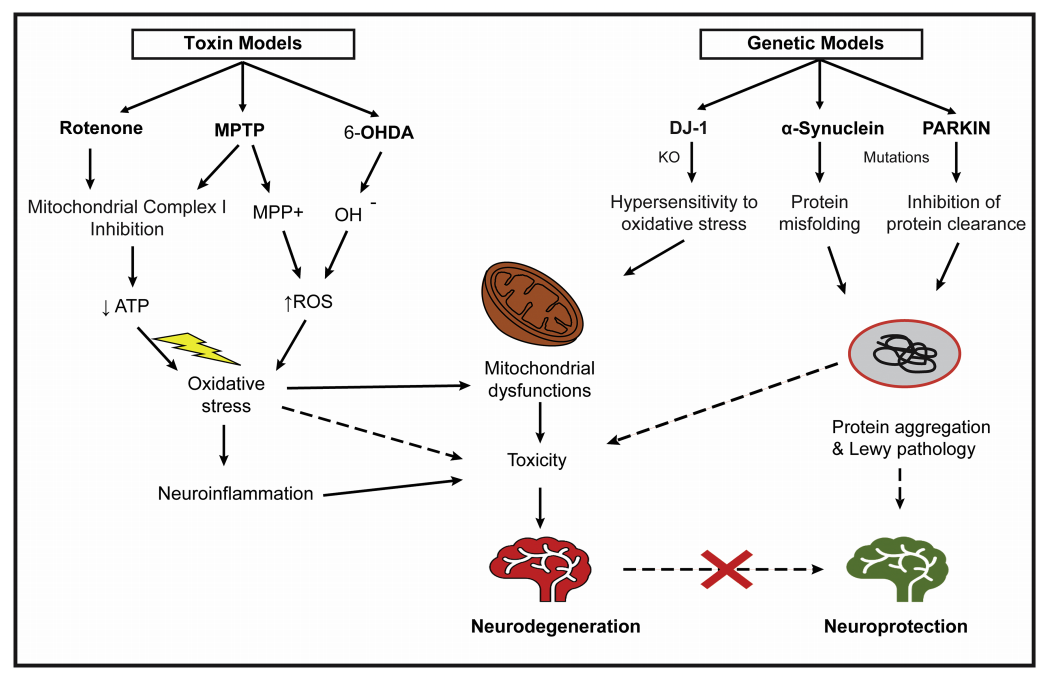
神经退行性疾病及其三种造模手段示例图
预制前体纤维(PFFs)是一种新的造模工具,在相关研究中得到越来越多的应用。这些预制纤维是在体外产生的,可以在动物和细胞模型中模仿内源性蛋白质聚集。因此,PFFs能够创建一个与神经退行性疾病中发现的特征(包括相关致病蛋白的“播种”和“传播”)更紧密一致的模型。
在PD中,α-Syn PFF模型通常用于模拟两个主要的疾病过程:神经元内路易体/神经突的积累和中脑多巴胺神经元的选择性变性。α-Syn PFFs能有效地在野生型小鼠内源性α-Syn的种子中聚集和纤维化。在一项研究中,注射α-Syn PFFs后鉴定到α-Syn过度磷酸化沉积。注射后30天,路易体样堆积沿着神经连接间传播,这表明存在细胞间传播方法。此外,研究者还观察到了与PD相关的临床症状,包括平衡和运动协调障碍。总的来说,单次纹状体内注射错误折叠的α-Syn PFFs足以引发与PD相关的神经退行性级联,包括路易体病理、多巴胺能神经元丢失和运动功能受损。
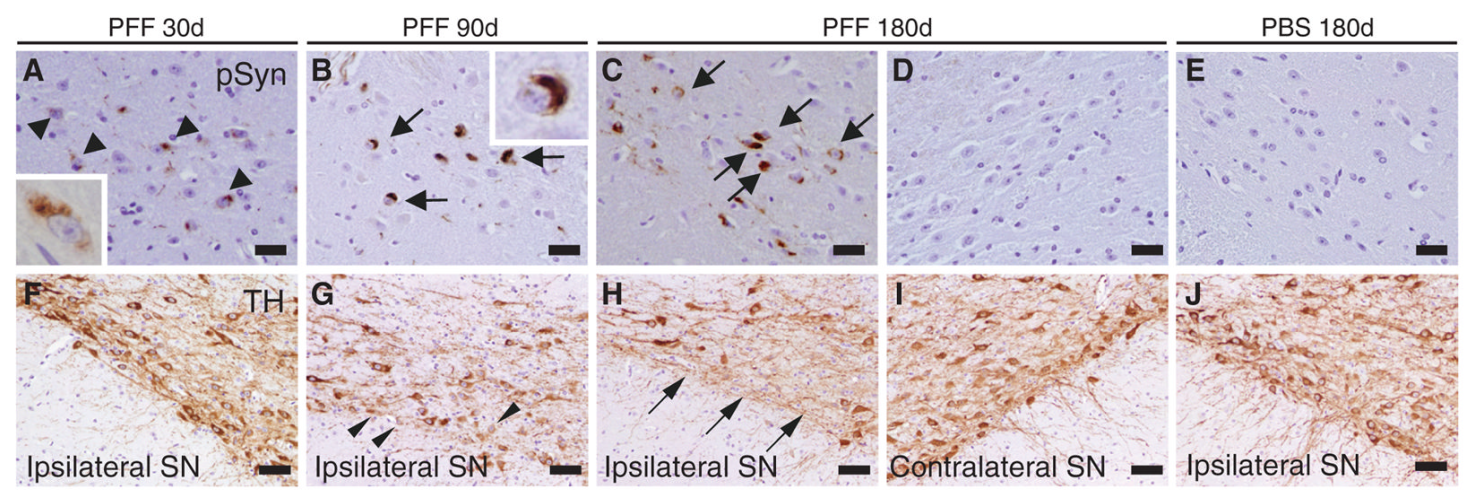
α-Syn PFFs验证错误折叠的α-Syn组成路易体的细胞间传输
虽然神经退行性疾病中聚集的蛋白质可能不同,但疾病的进展和临床指征是相似的。Aneuro是ACROBiosystems百普赛斯专注于神经领域的品牌,可提供PFFs系列产品,助力打造神经退行性疾病模型。基于稳定的、可量化的表征以及可重复的方案的验证,PFFs在疾病模型中的结构特征和活性机制将更加明确,从而在大规模药物筛选和测试中得以应用。

★ 由高质量单体诱导:单体纯度及均一性经MALS验证>90%,更利于PFFs的形成和保证诱导活性;
★ 单体内毒素≤1.0 EU/μg,适合各类细胞和动物实验;
★ 通过电镜和ThT荧光检测全面验证PFFs的聚集形态和招募活性,分享protocol;
★ 提供更个性化的产品与服务,多种荧光标记方案可供选择: Star Staining 定点标记,Biotin标记,化学标记等,满足体内、体外实验不同需求;
★ 货期及批间更稳定,质控严格,性价比高;
Alpha-Synuclein monomer on SDS-PAGE under reducing (R) condition. The gel was stained overnight with Coomassie Blue. The purity of the protein is greater than 90%.
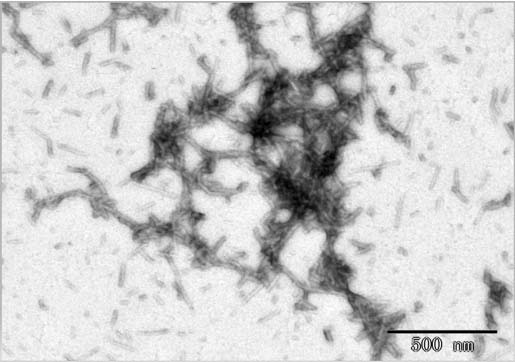
Transmission electron microscopy (TEM) of alpha-synuclein preformed fibrils (Cat. No. ALN-H51H4). Fibril structure is visible on negative stain TEM images of ALN-H51H4.
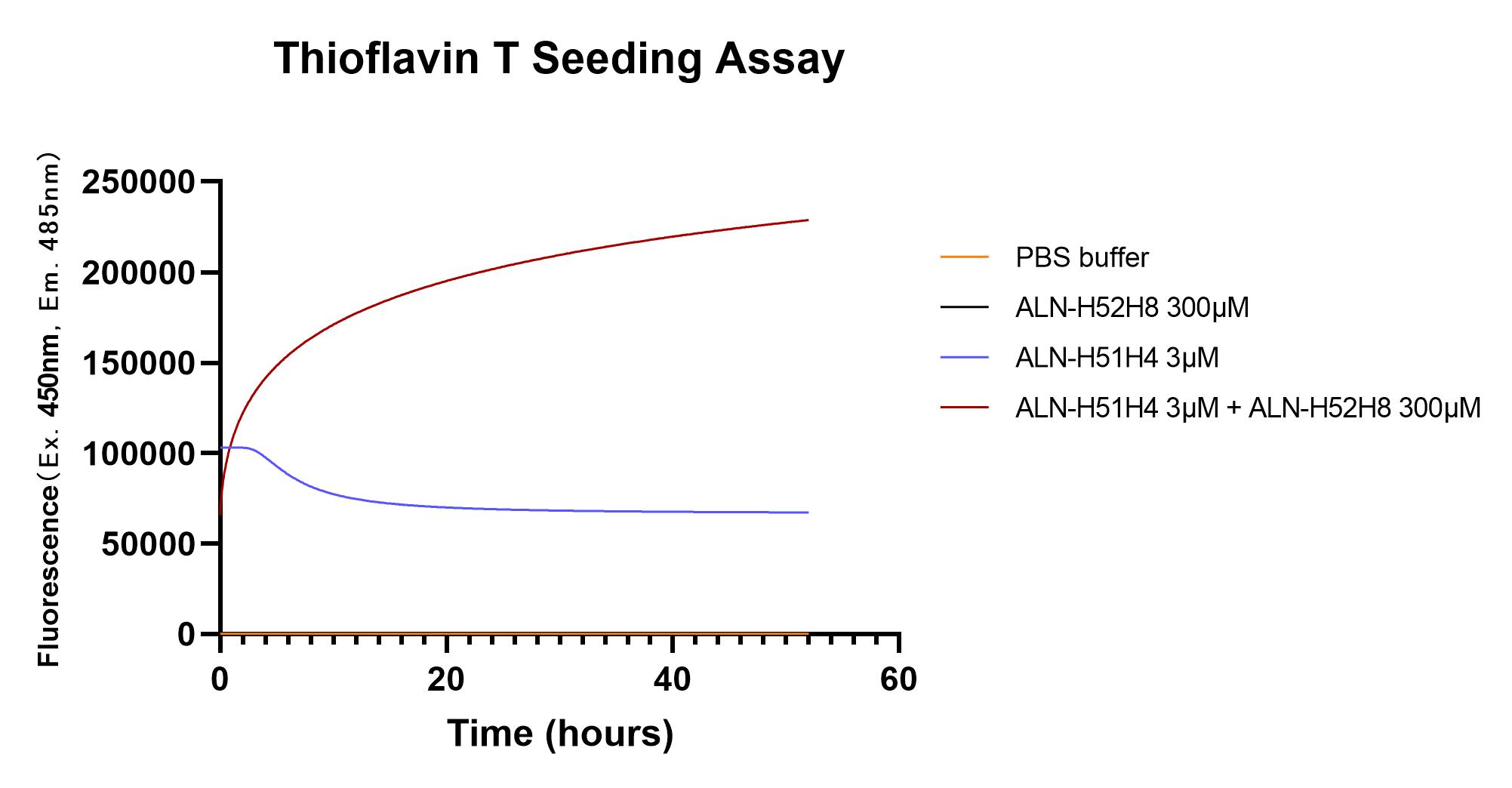
Thioflavin T is a sensitive fluorescence reporter of fibrils formulation that binds to beta sheet-rich structures. The alpha synuclein pre-formed fibrils (Cat. No. ALN-H51H4) is able to induce the aggregation of alpha synuclein monomers (Cat. No. ALN-H52H8).
参考文献
1. Volpicelli-Daley LA, Luk KC, et al. Exogenous α-Synuclein fibrils induce Lewy body pathology leading to Synaptic dysfunction and neuron death. Neuron. 2011; 72(1):57-71.
2. Tanudjojo, B., Shaikh, S.S., Fenyi, A. et al. Phenotypic manifestation of α-Synuclein strains derived from Parkinson’s disease and multiple system atrophy in human dopaminergic neurons. Nat Commun. 2021; 12, 3817.
3. Pediaditakis I, Kodella KR, Manatakis DV, et al. Modeling alpha-Synuclein pathology in a human brain-chip to assess blood-brain barrier disruption. Nat Commun. 2021;12(1):5907.
4. Luk KC, Kehm V, Carroll J, et al. Pathological α-Synuclein transmission initiates Parkinson-like neurodegeneration in nontransgenic mice. Science. 2012; 338(6109):949-53.
5. Raza C, Anjum R. Parkinson's disease: Mechanisms, translational models and management strategies[J]. Life sciences, 2019, 226: 77-90.

























 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!




























 膜杰作
膜杰作 Star Staining
Star Staining