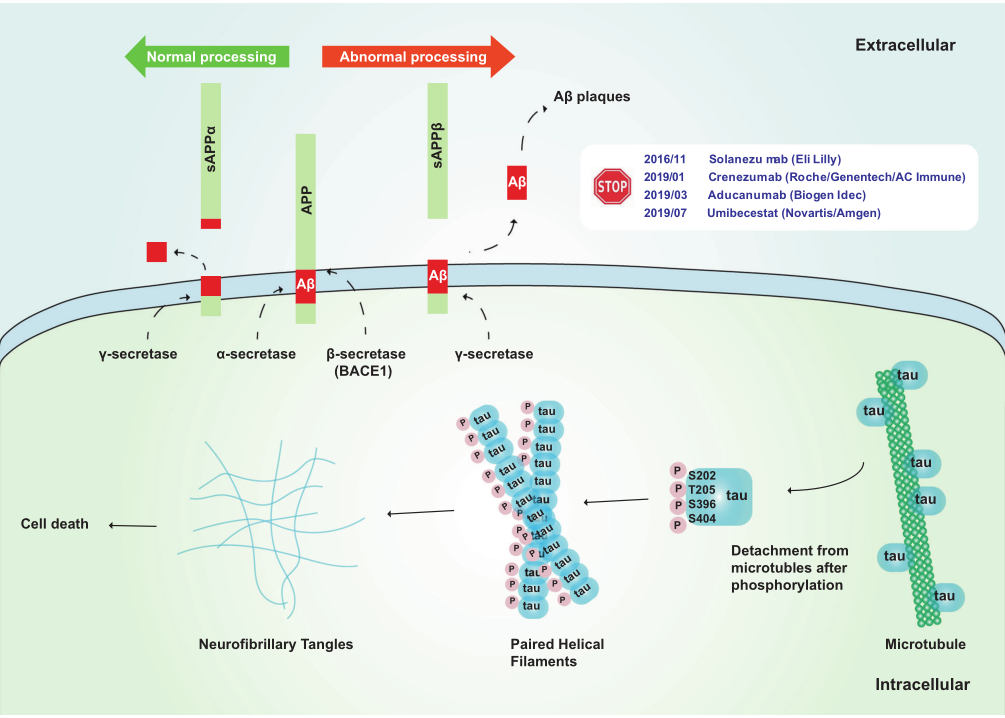
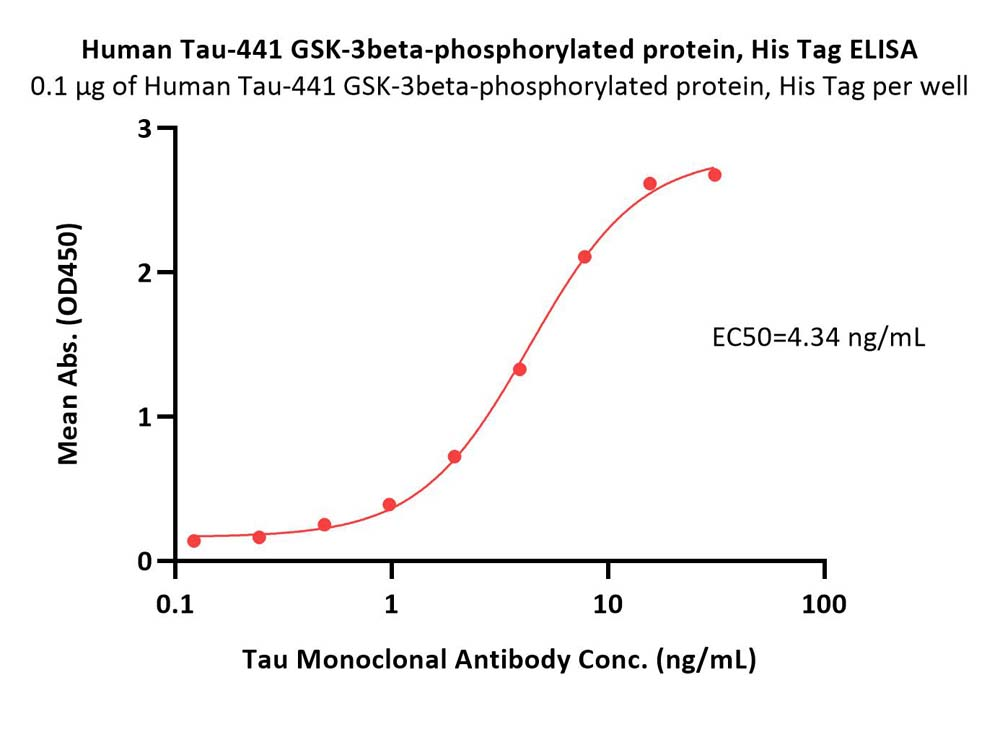
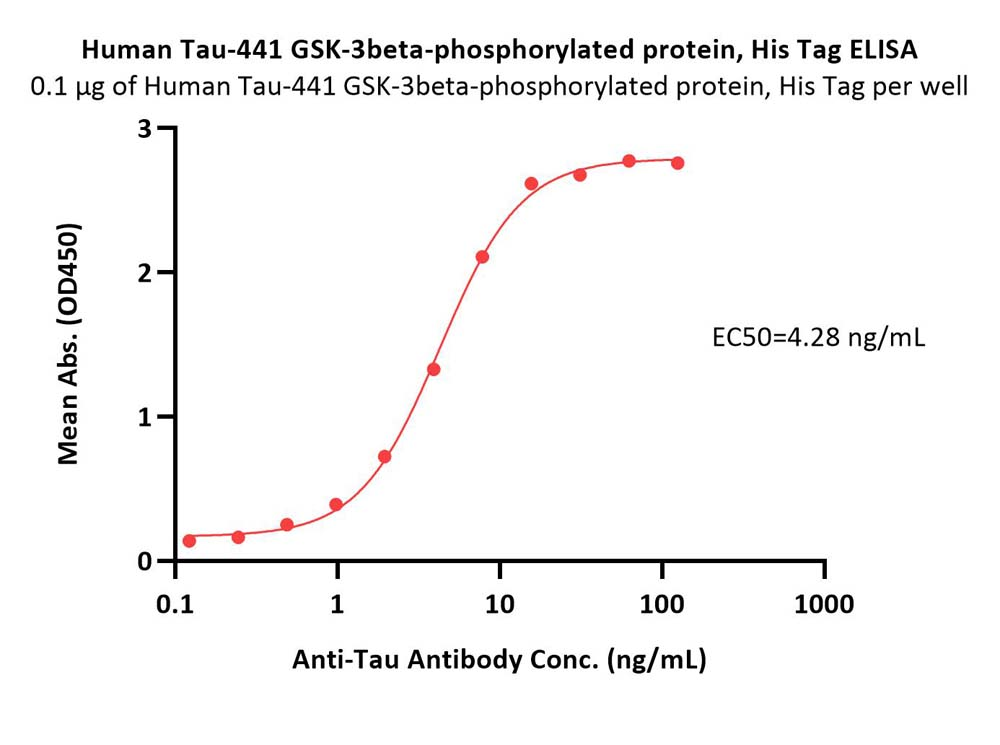
Aβ淀粉样级联假说和tau假说示意图
2023年7月,在阿尔茨海默病协会国际会议(AAIC)上,二十年来首款获得美国食品药品监督管理局(FDA)全面批准的AD治疗药物仑卡奈单抗(Lecanemab)的最新研究结果显示:在使用 Lecanemab 单抗治疗18个月后,处于AD病程更早阶段的受试者(低水平Tau组),整体功能衰退速度减慢了549%,部分早期患者甚至出现了「病程逆转」。

然而,Lecanemab的3期临床研究结果显示:患者病理改变越轻度,其靶向治疗的效果越明显,这提示疾病早期诊断干预或让AD患者受益。
Tau是一种磷蛋白,正常低水平的磷酸化才能发挥最佳功能,而高水平异常磷酸化的Tau则失去生物学活性。在正常的人脑中,每摩尔Tau含2~3 mol磷酸盐,且负调节Tau与微管的结合。而在AD脑中,Tau被3~4倍过度磷酸化,每摩尔Tau含有8 mol磷酸盐,磷酸化水平达到饱和,并聚成神经原纤维缠结。Tau的过度磷酸化会诱导恶性循环,促进Tau病理在脑中的传播以及在人脑脊液( CSF) 中的积累。因此,Tau的过度磷酸化可能是AD认知障碍的风险机制。
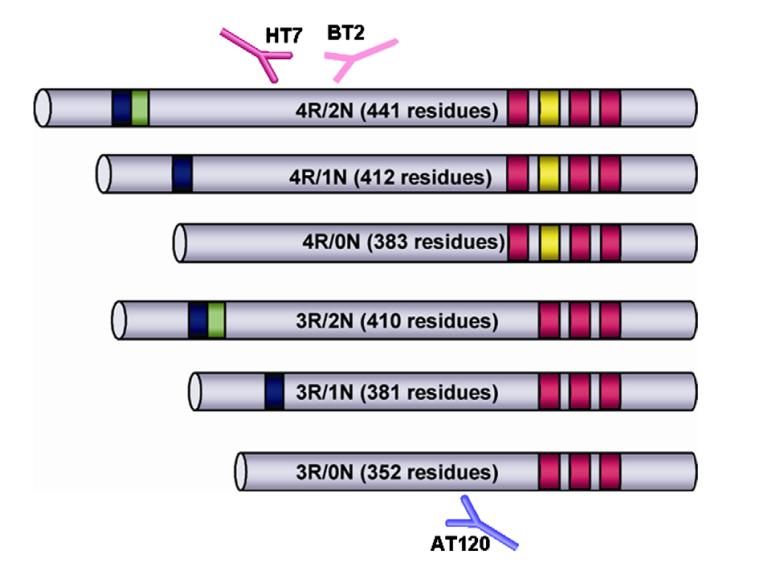
Tau的6种异构体形式
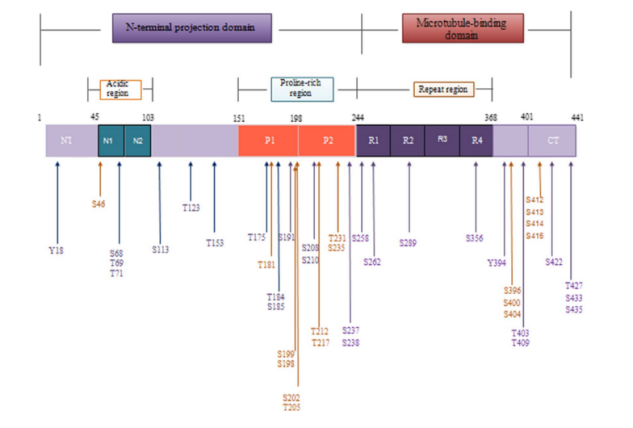
在由 441 个氨基酸组成的最长的人类Tau亚型中,总共有 85 个可磷酸化位点。异常高磷酸化的Tau可以隔离正常Tau与微管,进一步破坏微管动力学,但需要多个位点同时磷酸化才能破坏Tau与微管之间的相互作用。在AD神经退行性病变早期,Thr212,Thr231 和 Ser262 这三个磷酸化升高位点的组合可将Tau转化为毒性分子,进而导致微管网络的破坏和细胞死亡; 磷酸化的 Thr231 是对去磷酸化具有异常抵抗力的残基,磷酸化水平升高可预测轻度认知障碍患者向 AD 的转化进程; Thijssen等人研究指出:血浆磷酸化Tau蛋白181位点水平可以将AD与健康人群区分开来,因此磷酸化Thr181 是目前公认的CSF中的AD 核心生物标志物。
参考文献
1.Saura C A, Parra-Damas A. Is phosphorylated tau a good biomarker of synapse pathology in Alzheimer’s disease?[J]. Brain Communications, 2023, 5(3): fcad142.
2.Ariafar S, Makhdoomi S, Mohammadi M. Arsenic and Tau Phosphorylation: a Mechanistic Review[J]. Biological Trace Element Research, 2023: 1-13.
3.刘硕,曹云鹏.阿尔茨海默病脑TAU蛋白磷酸化位点综述[J].中风与神经疾病杂志,2022,39(09):857-860.DOI:10.19845/j.cnki.zfysjjbzz.2022.0215.
4.Liu P P, Xie Y, Meng X Y, et al. History and progress of hypotheses and clinical trials for Alzheimer’s disease[J]. Signal transduction and targeted therapy, 2019, 4(1): 29.
5.Hampel H, Blennow K, Shaw L M, et al. Total and phosphorylated tau protein as biological markers of Alzheimer’s disease[J]. Experimental gerontology, 2010, 45(1): 30-40.
6.丁香园公众号.






















 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!






























 膜杰作
膜杰作 Star Staining
Star Staining