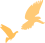司美格鲁肽是由诺和诺德(Novo Nordisk)于2012年开发的胰高血糖素样肽-1受体(GLP-1R)激动剂,其结构与胰高血糖素样肽-1(GLP-1)类似,只是侧链被修改,通过模仿肠GLP-1的作用,增加胰岛素的产生,从而起到降糖的作用。司美格鲁肽商品名分别为Ozempic、Rybelsus和Wegovy,三者的规格、推荐剂量及适应症不同,不能互相替代。Ozempic、Rybelsus分别作为皮下注射剂和口服制剂用于成人2型糖尿病血糖控制,仅Wegovy获批减肥适应症。
埃隆.马斯克表示他正在使用司美格鲁肽Wegovy并节食以维持体重和身体健康
①刺激胰岛素分泌:在血糖升高的情况下,GLP-1可以刺激胰岛β细胞分泌胰岛素;
②抑制胰高血糖素分泌:在存在食物的情况下,GLP-1可以抑制胰高血糖素的分泌,从而避免血糖过度上升;
③延缓胃排空:这可以帮助减缓餐后血糖的上升速度;
④提高饱腹感:这有助于减少食欲,从而对某些患者有助于减重。
由此,除了被用于2型糖尿病治疗外,GLP-1R激动剂也因其减重效果,被用作治疗肥胖症的药物,以及降低糖尿病、肥胖等并发症。
以司美格鲁肽为代表的GLP-1R激动剂始于糖尿病治疗,如今风靡全球成为最受欢迎的减肥药,且进一步发现其对糖尿病/超重所致的并发症如冠心病、肾病等有预防作用,GLP-1R激动剂由此开启了“野蛮成长之路”。
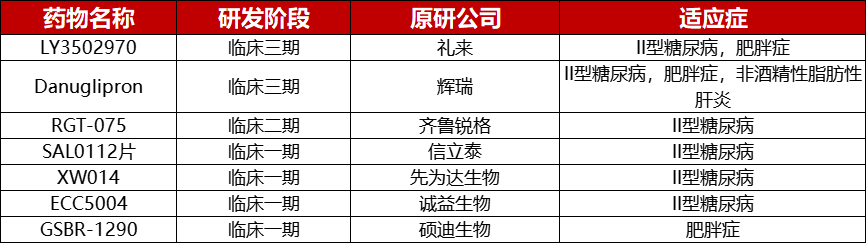
糖尿病是一种慢性病,当胰腺产生不了足够的胰岛素或者人体无法有效地利用所产生的胰岛素时,就会出现糖尿病。胰岛素是一种调节血糖的荷尔蒙。高血糖或血糖升高是糖尿病失控的常见后果,随着时间的推移会对人体的许多系统(特别是神经和血管)带来严重损害。在药物布局方面,随着人们对GLP-1R激动剂研究的不断深入,特别是对其在II型糖尿病和肥胖症中的作用机制不断了解,目前全球已有13款GLP-1RA药物获批上市,并有8款接受程度更高的口服GLP-1降糖药物进入临床实验阶段。
全球获批GLP-1R激动剂药物
相较于注射类药物,糖尿病患者对口服药物的接受性更高。在此前的100年里,人们均未能成功研发出口服胰岛素药物。直到2019年,诺和诺德开发出降糖药物司美格鲁肽Rybelsus(口服型)并成功上市,由此也掀起了口服GPL-1R降糖药的市场热潮。
口服GLP-1R激动剂开发情况
全球首个GLP-1R/GIPR/GCGR三激动剂启动Ⅲ期临床实验
2023年5月31日,根据美国Clinicaltrials.gov网站显示,礼来登记了名为TRIUMPH-3 (NCT05882045)的Ⅲ期临床实验。实验目标是评估全球第一款进入Ⅲ期临床阶段的GLP-1R/GCGR/GIPR激动剂药物Retatrutide (LY3437943) 在每周一次的条件下用于治疗患有心血管疾病肥胖受试者的疗效及安全性。
GLP-1R/GIPR/GCGR多重激动剂可激活血糖调控受体分子机制:GLP-1R(胰高血糖素样肽-1受体)、GIPR(葡萄糖依赖性促胰岛素释放多肽受体)和GCGR(胰高血糖素受体)是维持人体血糖平衡重要的“调节器”,为Ⅱ型糖尿病和肥胖症的重要治疗靶标。其中GLP-1R具有促进胰岛素分泌、降低血糖和减轻体重等作用,GIPR在高血糖时增加胰岛素分泌、在低血糖时则刺激胰高血糖素的释放,而GCGR可参与人体血糖及能量的调节。近年来,GLP-1R/GIPR双重激动剂和GLP-1R/GIPR/GCGR三重激动剂在体内、外实验中显示出了比单激动剂更为优越的药理效应,成为多家跨国大药企的竞争领域。
GLP-1(Glucagon-like peptide-1,胰高血糖素样肽-1)是一种由回肠和结肠L细胞分泌的多肽类激素,其受体GLP-1R在胰腺组织中的胰岛β细胞和胃、小肠、心脏、肾脏、肺及大脑等组织中广泛表达。
GLP-1 受体信号通过mTOR依赖性HIF-1α激活促进β细胞葡萄糖代谢[1]
如图所示,GLP-1与GLP-1R结合,通过mTOR依赖性HIF-1α的激活促进胰岛β细胞葡萄糖的代谢。GLP-1结合后,G蛋白偶联GLP-1R受体激活腺苷酸环化酶(AC),增加细胞内cAMP水平。由cAMP介导的信号传导促进了β细胞中的mTOR途径,该途径诱导HIF-1α的翻译激活。在细胞核中,HIF-1α驱动糖酵解基因转录上调。细胞质中糖酵解酶池的增加允许糖酵解通量和糖酵解能力升高,导致ATP的产生更快,并增强葡萄糖刺激的胰岛素分泌。
由于GLP-1受体激动剂(GLP-1RA)能通过激动GLP-1受体促进发挥肠促胰岛素而产生良好降糖和减肥效果,所以GLP-1RA在Ⅱ型糖尿病和肥胖症治疗中受到广泛关注。
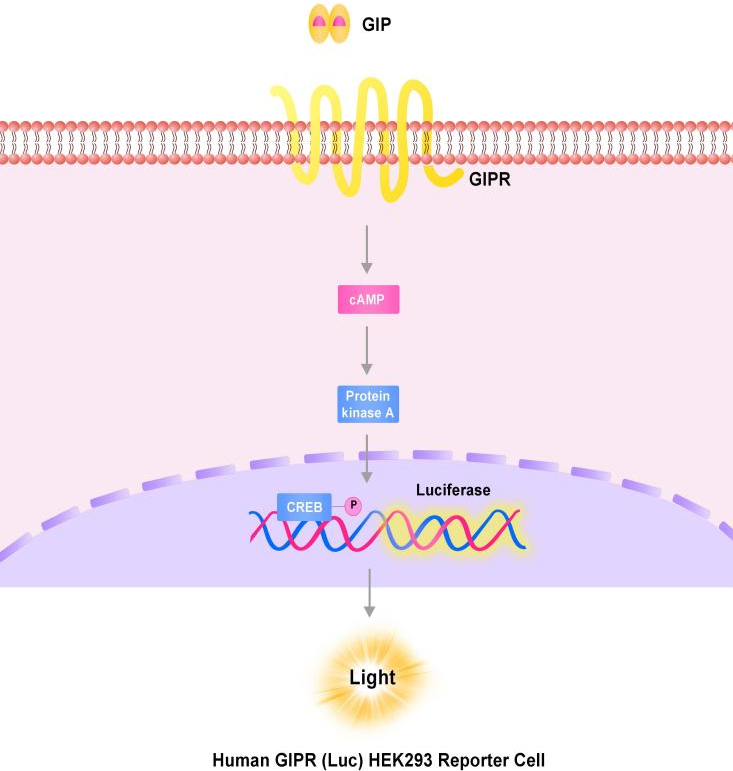
GIP(Glucose-dependent insulinotropic polypeptide,葡萄糖依赖性促胰岛素释放多肽)是一种由42个氨基酸组成的多肽,与GLP-1同属两种人体内的主要内源性胰岛素,由小肠中十二指肠、空肠肠粘膜的K细胞所分泌。食物中的碳水化合物、脂肪等营养素均属于人类GIP分泌的有效刺激物。
GIPR介导的信号传导途径[2]
GIP受体GIPR(葡萄糖依赖性促胰岛素释放多肽受体)属于G蛋白偶联受体 (GPCR) 超家族的B1亚家族,由胞外N端、胞内C端和7个跨膜结构域组成,在胰腺B细胞中大量表达。激活GIPR会引发促胰岛素反应,GIPR与配体GIP结合,可与Gsα (G蛋白激活型α亚基) 结合诱导腺苷酸环化酶活化,增加细胞质中cAMP(环磷酸腺苷)水平。cAMP的增加可导致PKA(蛋白激酶A)调节亚基从催化亚基中分离,转移至细胞核中并促进CREB磷酸化,使GH(胰岛素低血糖兴奋生长激素)表达增加,刺激胰岛素产生使血糖降低。而在人体血糖处于较低水平时,GIPR激活可让促胰高血糖素作用更加明显,增强胰高血糖素分泌使血糖升高以达到调节血糖的作用[3]。
GCGR(Glucagon receptor,胰高血糖素受体)和GIPR同属GPCR超家族B1亚家族,在维持人类葡萄糖稳态中起到关键作用。
GCGR主要存在于肝脏。GCGR被其配体胰高血糖素(Glucagon)激活后,可在体内调节肝脏葡萄糖合成和分解代谢,从而维持体内血糖浓度。在体内,GCGR与配体结合主要通过激活Gs蛋白,从而激活腺苷酸环化酶以发挥ATP转化成cAMP(环磷酸腺苷)引起细胞的信号应答的作用。活化的GCGR通过与异三聚体Gs结合并诱导腺苷酸环化酶激活,进而产生cAMP并激活PKA(蛋白激酶A)使肝糖原分解及糖异生增加,最终导致体内血糖升高。GCGR与其配体GCG结合调节体内葡萄糖稳态,是Ⅱ型糖尿病的重要药物靶点[4]。
2023年5月31日,礼来在研的GIPR/GLP-1R/GCGR三重激动剂Retatrutide进入Ⅲ期临床阶段,该药物为全球首款进入Ⅲ期临床实验的GIPR/GLP-1R/GCGR三重激动剂,对葡萄糖依赖性促胰岛素多肽(GIP)、胰高血糖素样多肽(GLP-1)、胰高血糖素受体(GCGR)具有强大的活性。全球范围内,目前已有4款同类产品进入临床开发,其中韩美制药开发的efocipegtrutide处于II期研究阶段,优先开发NASH适应症。民为生物开发的INDMWN101于上周刚刚获批。
GLP-1R/GIPR/GCGR激动剂药物开发信息
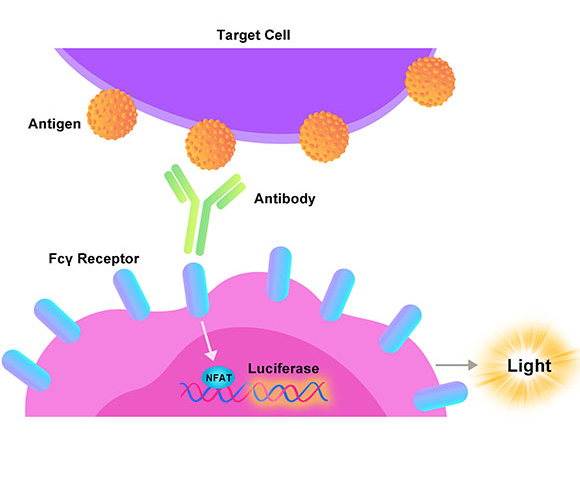
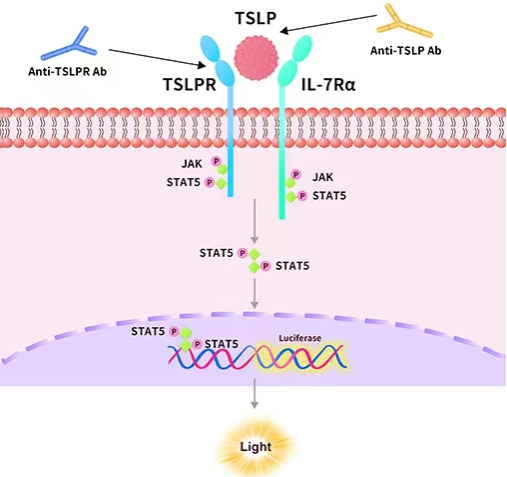
Human GLP-1R (Luc) HEK293报告基因细胞株、Human GIPR (Luc) HEK293报告基因细胞株、Human GCGR (Luc) HEK293报告基因细胞株,分别在HEK293细胞上过表达全长人GLP-1、GIPR及GCGR受体,并均转入受CREB信号调控转录的Luciferase 报告基因,在细胞内建立起靶点信号转导与Luciferase表达的相关性,通过监测发光信号值的变化评价相关药物的激动活性。

GLP-1R报告基因细胞株原理图
GIPR报告基因细胞株原理图
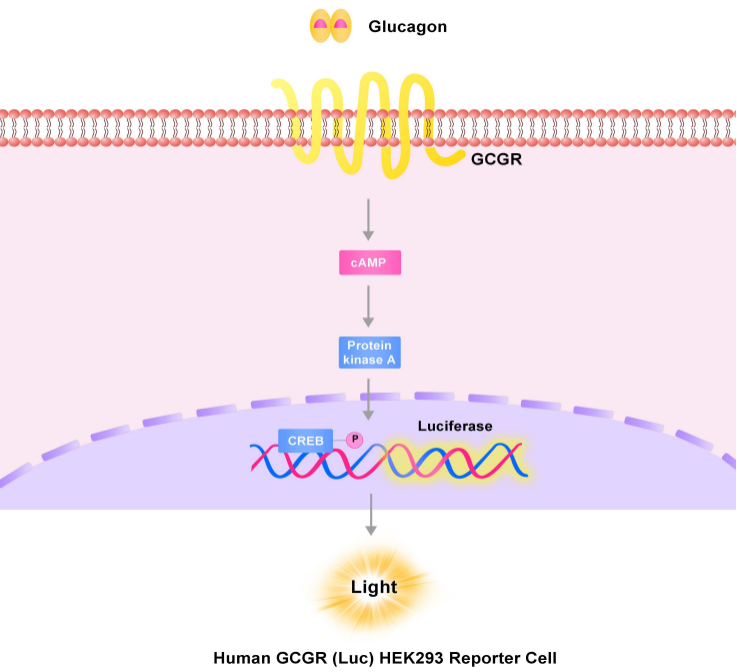
GCGR报告基因细胞株原理图
★ 细胞溯源清晰,提供商业授权选项;
★ 基于明确MOA设计,便于药物机制研究;
★ 采用萤光素酶(Luc)报告基因系统,反应信号强,灵敏度高;
★ 经过严格指控,确保足够的检测窗口, 适用不同药效筛选;
★ 经代次稳定性验证,可稳定传代>20代,利于方法学验证;
★ 售前免费样本测试,售后专业技术支持团队+无忧售后政策保障☛ 点击查看ACRO兜底售后政策;
★ 可提供临床申报及CMC所需支持文件,支持早期研发到CMC质控全流程。
● GLP-1R/GIPR/GCGR报告基因细胞株产品列表,点击列表即可查看产品详情

GLP-1R、GIPR、GCGR报告基因细胞株产品列表
● GLP-1R功能细胞株受体表达验证-FACS
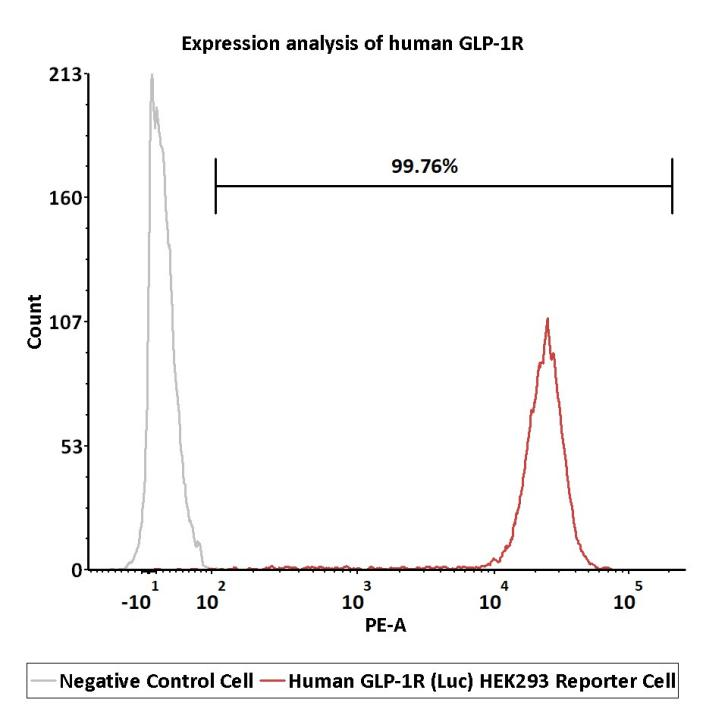
Expression analysis of human GLP-1R on Human GLP-1R (Luc) HEK293 Reporter Cell by FACS.
Cell surface staining was performed on Human GLP-1R (Luc) HEK293 Reporter Cell (Cat. No. CHEK-ATF096) or negative control cell using PE-labeled anti-human GLP-1R antibody.
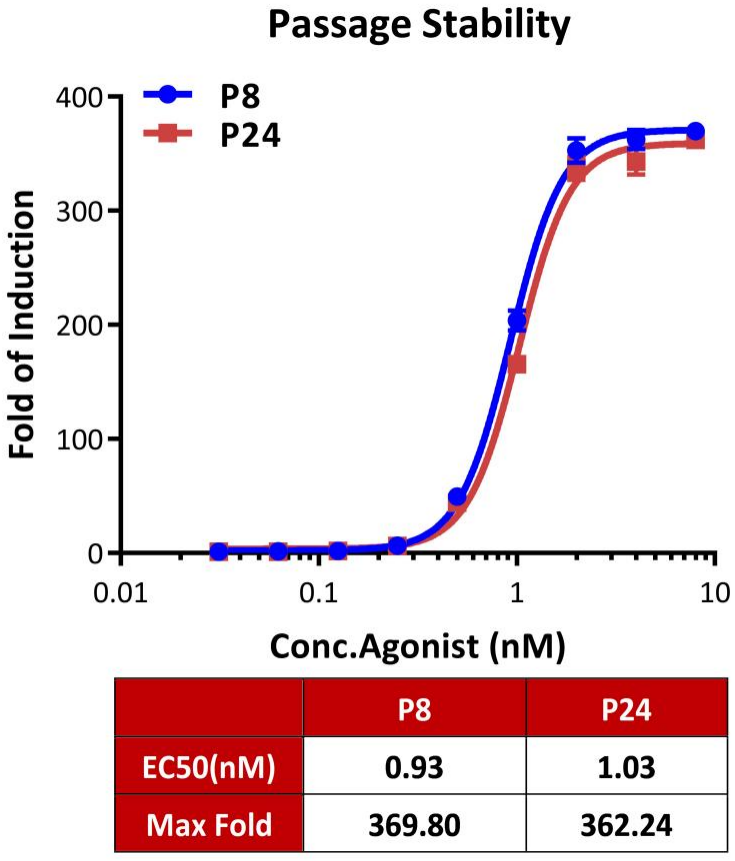
● GLP-1R功能细胞株次代稳定性验证-Fold
Passage stability analysis by Signaling Bioassay.
The continuously growing Human GLP-1R (Luc) HEK293 Reporter Cell (Cat. No. CHEK-ATF096) was stimulated with serial dilutions of Tirzepatide (a dual GLP-1R and GIPR agonist). Tirzepatide stimulated response demonstrates passage stabilization (fold induction and EC50) across passage 8-24.
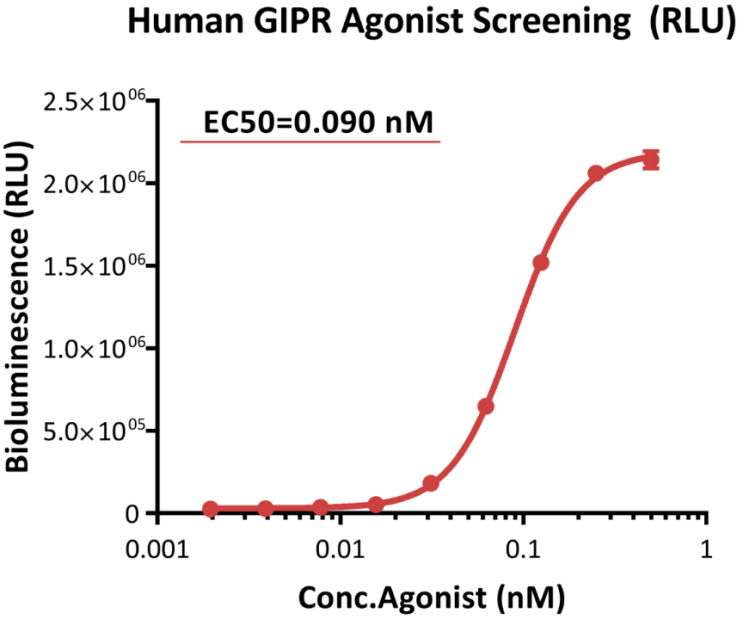
● GIPR激动剂筛选应用案例-RLU
This reporter cell (Cat. No. CHEK-ATF104) was incubated with serial dilutions of Tirzepatide (a dual GIPR and GLP-1R agonist). The EC50 of Tirzepatide was approximately 0.090 nM.
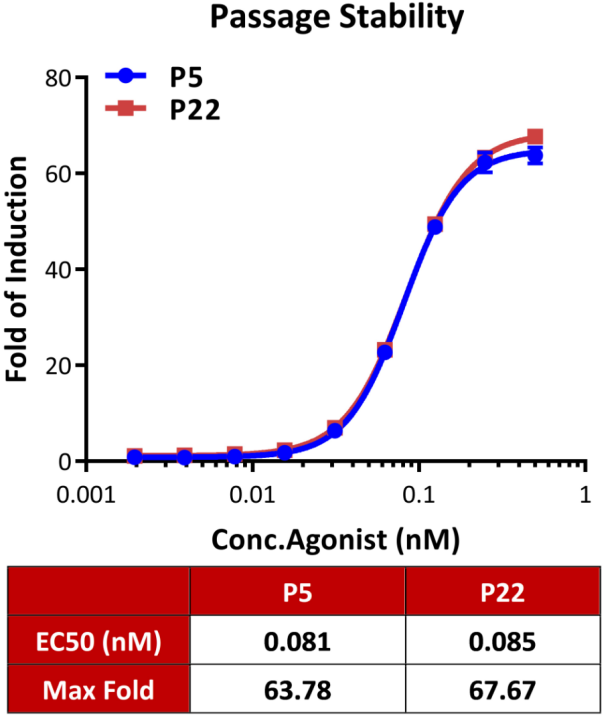
● GIPR功能细胞株次代稳定性验证-Fold
Passage stability analysis by Signaling Bioassay.
The continuously growing Human GIPR (Luc) HEK293 Reporter Cell (Cat. No. CHEK-ATF104) was stimulated with serial dilutions of Tirzepatide (a dual GIPR and GLP-1R agonist). Tirzepatide stimulated response demonstrates passage stabilization (fold induction and EC50) across passage 5-22.
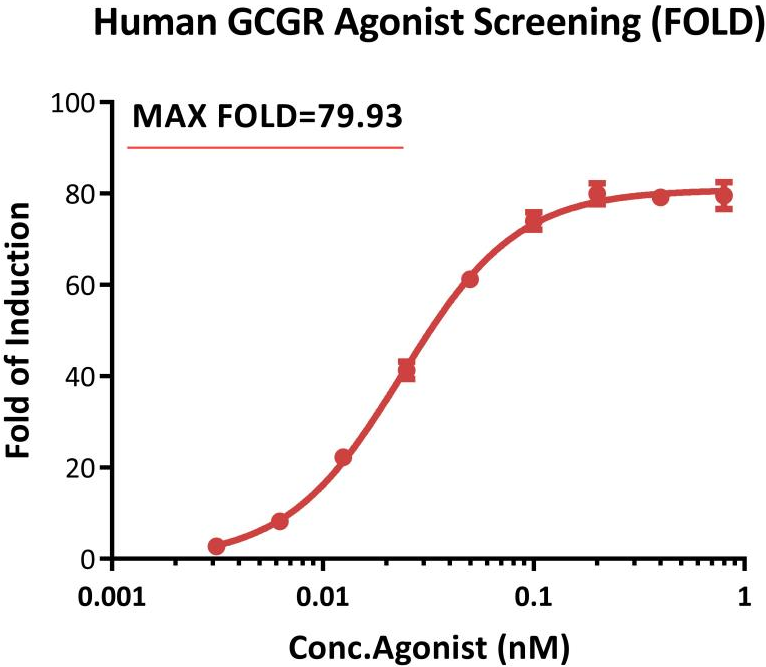
Bioactivity analysis of human GCGR agonist (FOLD).
This reporter cell (Cat. No. CHEK-ATF103) as incubated with serial dilutions of Retatrutide (a triple agonist peptide of GCGR, GIPR and GLP-1R). The max induction fold was approximately 79.93.
● GCGR功能细胞株次代稳定性验证-FACS
Passage stability analysis of receptor expression by FACS.
Flow cytometry surface staining of human GCGR on Human GCGR (Luc) HEK293 Reporter Cell (Cat. No. CHEK-ATF103) demonstrates consistent mean fluorescent intensity across passage 7-20.
● GLP-1R/GCGR重组蛋白产品列表,点击列表即可查看产品详情

● GLP-1R高纯度:经SDS-PAGE,SEC-MALS验证

The purity of Human GLP1R Protein, Fc Tag (Cat. No. GLR-H5253) is greater than 90% verified by SDS-PAGE and more than 85% verified by SEC-MALS.
● GLP-1R高生物活性:经ELISA验证
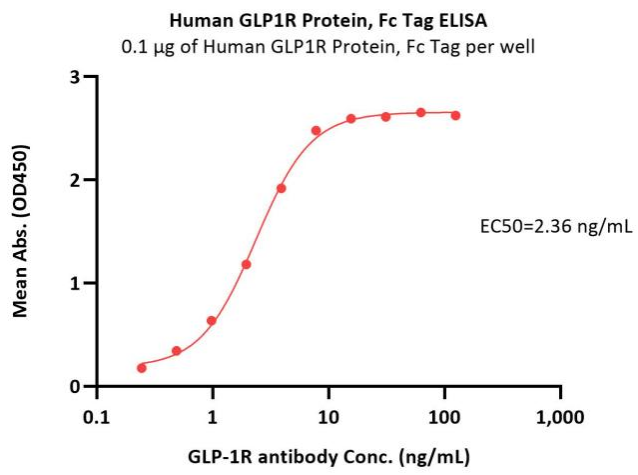
Immobilized Human GLP1R Protein, Fc Tag (Cat. No. GLR-H5253) at 1 μg/mL (100 μL/well) can bind GLP-1R antibody with a linear range of 0.2-8 ng/mL (QC tested).
● GGCGR高纯度:经SDS-PAGE,SEC-MALS验证
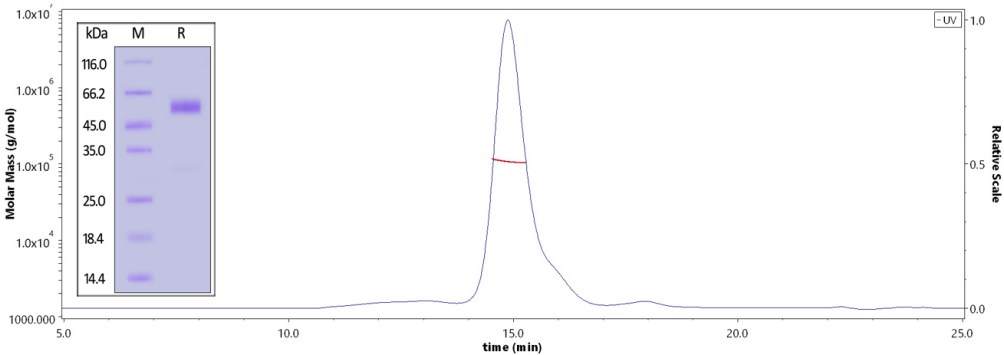
The purity of Human GCGR / Glucagon receptor Protein, Fc Tag (MALS verified) (Cat. No. GCR-H53H3) is greater than 95% verified by SDS-PAGE and more than 90% verified by SEC-MALS.
● GCGR高生物活性:经SPR验证
Biotinylated Human GCGR / Glucagon receptor, His,Avitag (Cat. No. GCR-H82E3) immobilized on CM5 Chip can bind GLP-1 (7-37) with an affinity constant of 48.5 μM as determined in a SPR assay (Biacore 8K) (QC tested).
ACROBiosystems百普赛斯全面助力抗体药物研发,在原有的靶点蛋白业务基础上推出了以:ADCC及ADCP功能验证用报告基因细胞系、靶点及通路研究、Cross-linking药物评价、免疫检查点药物研究为分类的四大主线产品,为您提供更加全面的抗体药质量表征解决方案!
参考资料:
1. Carlessi, R., Chen, Y., Rowlands, J. et al. GLP-1 receptor signalling promotes β-cell glucose metabolism via mTOR-dependent HIF-1α activation. Sci Rep 7, 2661 (2017). https://doi.org/10.1038/s41598-017-02838-2
2. Chang M, Yang C, Bao X, Wang R. Genetic and Epigenetic Causes of Pituitary Adenomas. Front Endocrinol (Lausanne). 2021;11:596554. Published 2021 Jan 26. doi:10.3389/fendo.2020.596554
3. Finan B, Müller TD, Clemmensen C, Perez-Tilve D, DiMarchi RD, Tschöp MH. Reappraisal of GIP Pharmacology for Metabolic Diseases. Trends Mol Med. 2016;22(5):359-376. doi:10.1016/j.molmed.2016.03.005
4. Wilson, Chantell, et al. "The paracrine hormone for the GCGR tumor suppressor, guanylin, is universally lost in colorectal cancer." Cancer Epidemiology and Prevention Biomarkers 23.11 (2014): 2328-2337.




















 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!



























 膜杰作
膜杰作 Star Staining
Star Staining