细胞和基因治疗(CGT)作为革命性的治疗手段,在治疗效果和作用机制方面相较于传统药物具有多方位的优势,是推动医疗领域迎来划时代变革的主导力量。截至2023,全球CGT在研管线超过2000个,呈逐季度上升趋势,但是作为新兴产业,细胞基因治疗产业仍面临不少监管挑战。目前,各国药监部门对细胞和基因治疗技术的认知不断加深,其监管思路也逐渐清晰,尤其是中国、美国作为CGT药物开发的主要市场,中、美药监部门针对CGT各个细分的指导原则不断出台。实际上,细胞基因治疗产品获批IND申报的主要挑战之一就是原辅料的质量控制及内外源病毒因子安全性评价。据悉,细胞治疗产品药学方面常见的注册合规性退审或发补的共性问题之一就是药企对于生产用关键原材料的合规评价及风险评估缺失或不足。
>>>点击下载CGT药物相关指导原则及政策文件资料包!
ACROBiosystems百普赛斯深入调研国内外(特别是中、美)CGT行业原材料相关的法规和标准,在GMP产品设计和开发之初,就将各项法规要求融入到我们GMP产品的设计输入中,矢志做出符合全球监管要求的“真正GMP级别”的原材料,更好助力CGT药物临床/上市申报。
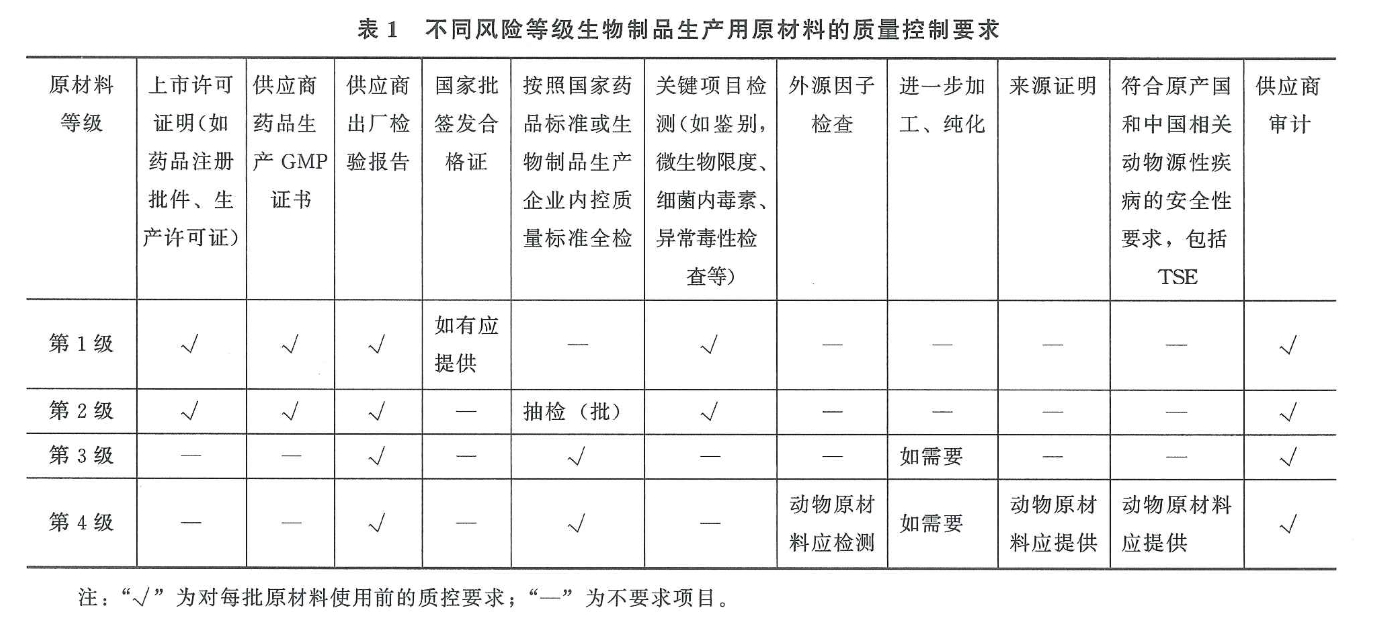
01 中国药典三部《生物制品生产用原材料及辅料质量控制》
解读:按照中国药典的要求,细胞因子等原材料属于风险等级第3级原材料。此类原材料供应商需提供出厂检验报告(CoA);用户(药企)需要制定此类物料的质检标准,并按照企业内控质检标准进行全检,并需要按照一定的频率对供应商进行审计。
✔ ACROBiosystems百普赛斯可提供:
02 USP〈1043〉《细胞、基因和组织工程产品的辅助材料》
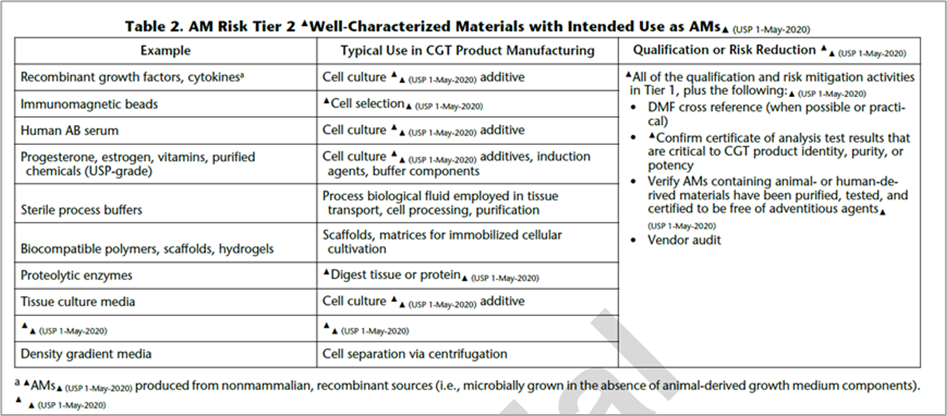
解读:USP 1043中按照对CGT产品工艺的重要程度以及风险评估,将辅助材料(AM)分为4级,其中Acro提供的多数细胞因子属于Tier 2。对于AM Risk Titer 2,法规要求供应商需要提供DMF;CoA;确定含有动物或人源材料的AM已被纯化,检测并不含外源因子;供应商审计。
✔ ACROBiosystems百普赛斯可提供:
-
● CoA;
-
● DMF;
-
● 产品外源因子检测报告;
-
● 书面/线上/现场审计等。
03 IPRP读后报告-人用细胞和基因治疗制品生产用原材料的一般考虑因素

解读:该报告中的3.1部分,要求CGT生产商应建立包括原材料认证程序在内的质量管理体系,包括供应商批准、质量协议签订、CoA及其他支持性文件的提供、原材料储存要求、稳定性和有效期控制等。
✔ ACROBiosystems百普赛斯可提供:

解读:该报告3.3条款来源和可追溯性中,要求原材料应附有适当的文件,如原产地证书(COO),以便可追溯和识别生产过程中使用的原材料和/或其组分的来源。如果使用人或动物来源的原材料,CGT制品生产商应选择可获得其来源信息的原材料。这可以作为供应商资格的一部分来实施,可能包括与供应商达成协议,只提供由特定地区来源的材料制成的原材料。
✔ ACROBiosystems百普赛斯可提供:

解读:4.2原材料生产的微生物安全性中提到大多数CGT制品不经过终端灭菌。因此,CGT制品生产所用原材料的无菌性至关重要,应对CGT制品生产中使用的原材料进行无菌检测。传统的病毒灭活/去除程序(例如,加热、去污剂、低pH值或过滤)通常不适用于CGT制品。因此,在可能的情况下,如果使用生物来源的原材料,应首选使用经过验证的程序进行病毒灭活/去除步骤的原材料。如果这些步骤不可行,则应彻底检测原材料是否存在相关病毒,并应证明其使用的合理性。
✔ ACROBiosystems百普赛斯可提供:
04 EP 5.2.12《用于细胞和基因治疗药物产品生产的生物来源的原料》

解读:欧洲药典5.2.12章节,详细规定了用于细胞和基因治疗产品的生物来源原料在整个生命周期中的要求,其中3.2生产中写道:
(1)在一个合适的质量管理体系和生产设施中生产,严格无菌生产工艺,考虑添加剂(抗生素)的影响;原材料一般质量要求包括:鉴别、纯度、生物活性;杂质(残留HCP/DNA);微生物;病毒污染物;支原体;水分;含量;生物活性(比活)。
(2)原料是无菌的,并在无菌条件下生产和/或进行终端灭菌,除非另有说明。如果原料不是无菌的,必须知道微生物污染的水平。
✔ ACROBiosystems百普赛斯可提供:
05 ISO 20399: 2022(E)《生物技术—细胞治疗产品和基因治疗产品生产过程中的辅助材料》
2022年底由国际标准化组织发行的ISO 20399: 2022(E)《生物技术—细胞治疗产品和基因治疗产品生产过程中的辅助材料》标准里明确了AM供应商和用户的职责分工,ACROBiosystems百普赛斯及时识别到该法规的更新,针对职责分工的每一条都有对应的解决方案可以给客户提供。

ACROBiosystems百普赛斯如何支持客户中美双报
ACROBiosystems百普赛斯根据以上中外法规以及客户或官方要求总结了细胞/基因治疗使用GMP级别原材料所需的关键资质要求,并精心制作成RSF(法规支持文档)以满足处于不同阶段的客户申报使用。——您所关心的,正是我们所关注的。
Acro的RSF文档分为两级,一级文档为产品资质文档,对于购买过GMP产品的客户可免费提供(约40~60页)。
一级文档侧重于研发或临床前阶段的客户,此阶段客户在筛选原材料阶段,我们的一级文档可以作为充分的供应商资质证明以及产品简介说明文件提供给客户的采购和QA,我们一级文档的作用是新供应商准入阶段的必要证明文件。

二级文档我们定义为独特的质量和安全性文档,该级文档需要达到一定的采购量,并需要付费提供(1000+页)。
二级文档针对开始临床进程的客户,此阶段客户需要更多详细的原材料信息来支持他们的临床申报或上市许可。我们二级文档包含详细的质检方法sop以及分析方法验证报告,对于需要建立严格物料入厂标准的客户来说无疑为其节省了大量的分析方法开发、验证的时间、成本和人力。严格的物料控制策略以及详细的物料安全性检测报告也能够帮助客户缩短申报时间和减少发补的风险。

DMF是“Drug Master File”的简称,译为“药品主文件”是关于产品化学、生产和质量控制(CMC,Chemistry, Manufacturing and Controls)信息的一套完整文件资料,内容包括产品的一般信息、生产工艺、杂质研究、稳定性等方面的资料和数据。包括涉及该产品的核心机密,如详细工艺描述、关键工艺参数、完整的物料信息等。DMF的状态有两种:“A”=Active:激活状态,表示该DMF已获得归档号/登记号/备案号并被正常维护,可用;“I”=Inactive:未激活状态,表示该DMF已被持有人或FDA关闭,不可用。
ACROBiosystems百普赛斯于2020年7月首次实现重组蛋白试剂的DMF备案,是国内外第一家重组蛋白试剂通过FDA的DMF备案的公司。
目前我司已完成8个GMP产品的DMF备案(GMP-L15H13/GMP-L07H24/GMP-L21H25/GMP-MC0323/GMP-MC2824/GMP-NUES19/GMP-CA9S19/GMP-MBS001)以及2个Laminin蛋白的DMF备案(LA8-H5283/LA5-H5261),其他GMP产品也在陆续备案中。

在客户IND/BLA申报过程中,可以免费线上或现场支持客户回复监管机构所提出的跟原材料相关的问题。助力客户申报的成功。
ACROBiosystems百普赛斯拥有成熟专业的法规支持团队,已协助中国、美国、韩国等地的近10个客户完成CDE、FDA、KFDA的多项申报,积累了丰富的申报经验。我们可以提供完善的两级RSF文档以及全线产品DMF备案,助力处于不同阶段的客户的使用及申报要求。ACROBiosystems百普赛斯为您提供最优质的GMP产品以及最完善的法规支持文件,为您的药品申报之路持续保驾护航!




















 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!

































 膜杰作
膜杰作 Star Staining
Star Staining