参考文献
[1]THAMBYRAJAH R, BIGAS A. Notch Signaling in HSC Emergence: When, Why and How [J]. Cells, 2022, 11(3).
[2]ARTAVANIS-TSAKONAS S, RAND M D, LAKE R J. Notch signaling: cell fate control and signal integration in development [J]. Science (New York, NY), 1999, 284(5415): 770-6.
[3]TAKAHASHI K, TANABE K, OHNUKI M, et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors [J]. Cell, 2007, 131(5): 861-72.
[4]KARAGIANNIS P, KIM S I. iPSC-Derived Natural Killer Cells for Cancer Immunotherapy [J]. Mol Cells, 2021, 44(8): 541-8.
[5]ZHANG L, TIAN L, DAI X, et al. Pluripotent stem cell-derived CAR-macrophage cells with antigen-dependent anti-cancer cell functions [J]. J Hematol Oncol, 2020, 13(1): 153.
[6]KNORR D A, NI Z, HERMANSON D, et al. Clinical-scale derivation of natural killer cells from human pluripotent stem cells for cancer therapy [J]. Stem Cells Transl Med, 2013, 2(4): 274-83.
[7]IRIGUCHI S, YASUI Y, KAWAI Y, et al. A clinically applicable and scalable method to regenerate T-cells from iPSCs for off-the-shelf T-cell immunotherapy [J]. Nat Commun, 2021, 12(1): 430.
[8]MICHAELS Y S, EDGAR J M, MAJOR M C, et al. DLL4 and VCAM1 enhance the emergence of T cell-competent hematopoietic progenitors from human pluripotent stem cells [J]. Sci Adv, 2022, 8(34): eabn5522.
[9]DITADI A, STURGEON C M, TOBER J, et al. Human definitive haemogenic endothelium and arterial vascular endothelium represent distinct lineages [J]. Nature Cell Biology, 2015, 17(5): 580-91.
[10]UENISHI G I, JUNG H S, KUMAR A, et al. NOTCH signaling specifies arterial-type definitive hemogenic endothelium from human pluripotent stem cells [J]. Nat Commun, 2018, 9(1): 1828.
[11]https://view.inews.qq.com/k/20230807A06NOO00?no-redirect=1&web_channel=wap&openApp=false [Z].















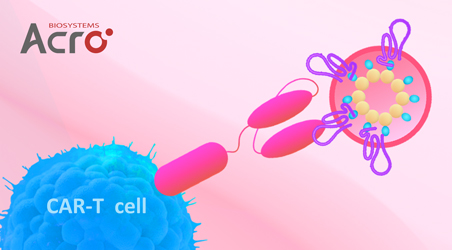
 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
































 膜杰作
膜杰作 Star Staining
Star Staining