狂犬病是由狂犬病毒引起的人畜共患病,每年造成数万人死亡,其中40%是15岁以下儿童。狂犬病广泛流行于世界150多个国家和地区,病例主要集中在亚洲和非洲。一旦病毒感染中枢神经系统并出现临床症状,则几乎是100%致命的。
尽管人类狂犬病致死率极高,但及时、适当地接种疫苗,狂犬病可被有效预防。疫苗接种被认为是唯一有效的狂犬病防治手段,也被认为是最为低成本高收益的治疗手段。狂犬病预防可分为暴露前预防(PrEP)和暴露后预防(PEP)。暴露前预防主要针对高暴露风险人群,例如实验人员、兽医和前往狂犬病疫区的旅行者。一旦人群发生狂犬病暴露,则需及时进行适当、准确的伤口护理、接种狂犬疫苗和免疫球蛋白(RIG)。无论是暴露前预防还是暴露后处置,疫苗都发挥着极其重要的作用。
数据显示,全球范围内每年有1500万人暴露后接种狂犬疫苗,多个国家地区(尤其是发展中国家及欠发达地区)对狂犬疫苗需求巨大。截至2024年,全球只有3种获得世卫组织预认证的人用狂犬病疫苗:印度血清研究所的RABIVAX-S疫苗、Zydus Lifesciences Limited公司的VaxiRab N疫苗和赛诺菲巴斯德公司的VERORAB疫苗。
狂犬病毒疫苗安全性和效力评估是疫苗开发过程的重要环节。灭活的人用或兽用狂犬病毒疫苗在实际疫苗接种前,都需要进行体内效力评估实验,使用待测疫苗对实验鼠进行接种后,再使用具有活性的狂犬病毒感染实验鼠,进行多次体内效力评估实验以确保疫苗终产品安全有效。长期以来,全球范围内不同疫苗生产监管机构普遍认可体内效力评估实验,这一体内效力评估实验起源于美国国立卫生研究院(NII),其被称为NIH动物法。NIH动物法被WHO采纳作为狂犬疫苗效力检测的金标准,目前也是全球范围内使用最为广泛的效力评估手段。但是NIH动物法存在一些不可忽视的缺陷:
-
实验过程中需在实验伊始和实验第7天注射疫苗至小鼠体内,首次免疫后第14天进行颅内攻毒,并持续观察实验动物。实验过程耗时,难以在生产过程中各个阶段进行疫苗效力评估。
-
培养狂犬病毒攻击毒株对实验平台、技术人员有较高要求,部分实验室无法顺利开展相关实验。
-
实验受到实验动物年龄和健康状况、实验人员操作、疫苗制备工艺、实验方法本身(如给药途径)等诸多因素的影响,实验重复性差,难以得到稳定可靠的实验结果。
-
实验动物需求量大,评估效力时,需测定标准品及疫苗样本,这一过程中需消耗大量实验动物,检测一份狂犬疫苗样本需大约120只小鼠,据统计美国和欧洲地区平均每年需要 5~7万只实验小鼠参与狂犬疫苗效力评估实验。
-
NIH动物法也给实验动物带来巨大痛苦。
近年来多个国际组织积极开展研究寻求可替代 NIH 动物法的体外效力评估方法,包括欧洲动物试验替代方法合作组织(EPAA)、验证替代方法的机构间协调委员会(ICCVAM)等。使用体外效力评估替代体内效力评估试验已在丙肝病毒、人乳头瘤病毒疫苗质控中得到验证。2012年 EPAA 研讨会上达成了一项科学共识,即针对狂犬病毒糖蛋白的标准化夹心酶联免疫吸附试验(ELISA)可作为人类狂犬疫苗体外效力检测试验的理想方法。
为助力狂犬疫苗效力评估及下一代狂犬疫苗开发,ACROBiosystems百普赛斯推出了抗原、抗体、试剂盒等狂犬病毒疫苗效力评估试剂关键试剂。
N蛋白抗体(货号:NUN-MY311)及N蛋白抗体检测试剂盒(货号:RAS-T179)新品上线,抢先订购!
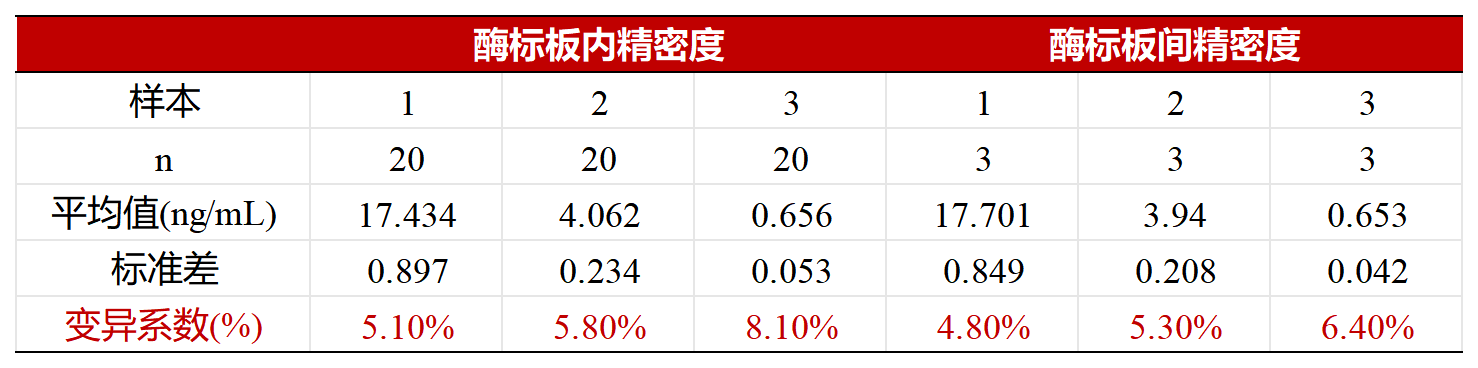
板内及板间精密度CV≤9%,优于试剂盒申明的标准范围(CV≤15%)。
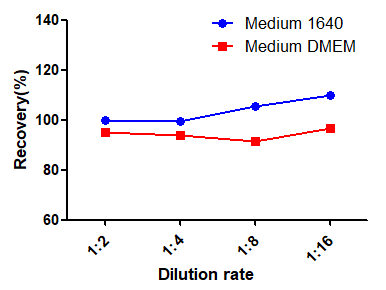
所有分析样本的平均回收率在80%-120%之间,优于接受范围。
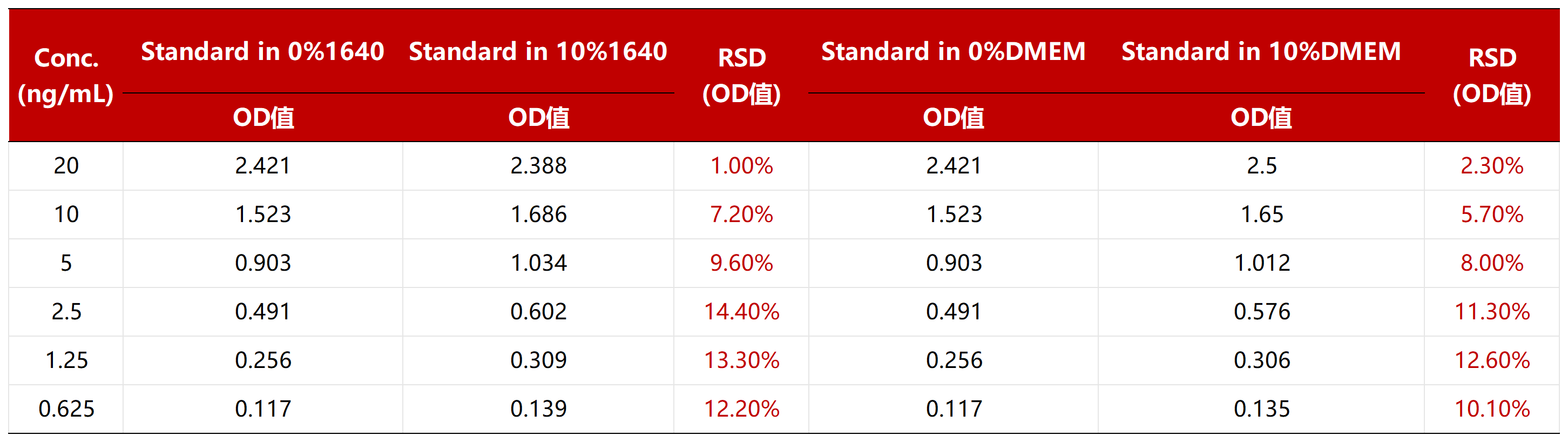
10%的1640培养基及10%的DMEM培养基对标准品检测的干扰,RSD均符合标准(RSD<15%)。如使用100%培养基,建议MRD=10。
扫描上方二维码或点击图片,获取传染病整体解决方案手册,解锁更多验证数据




















 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!

































 膜杰作
膜杰作 Star Staining
Star Staining