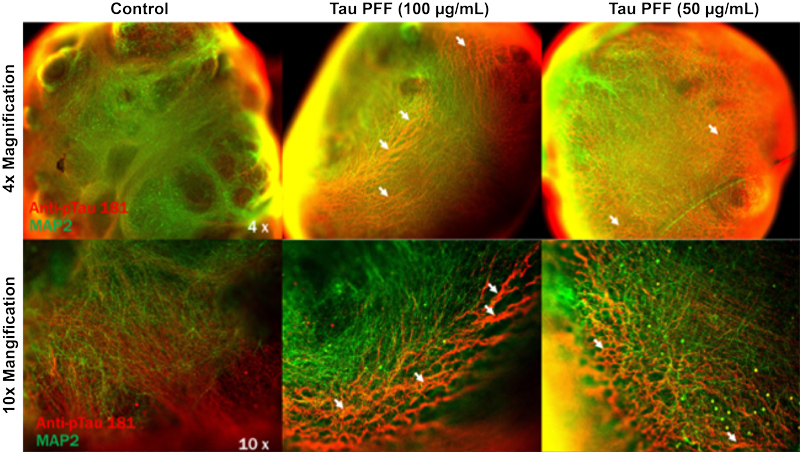
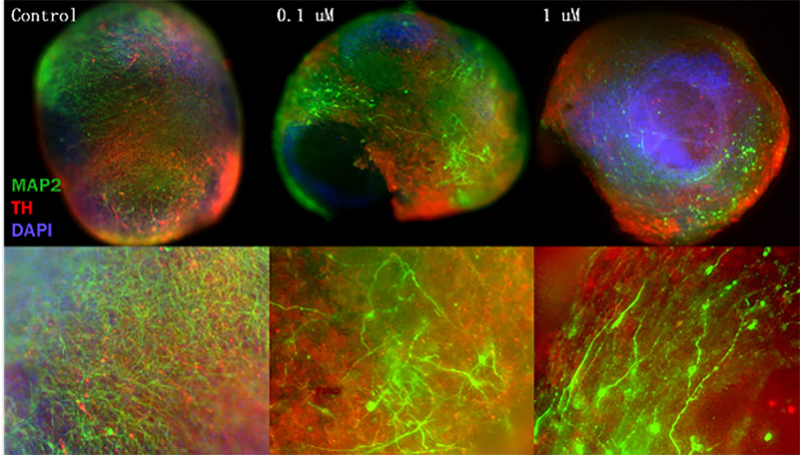
参考文献
1.Rawat, P., Sehar, U., Bisht, J., Selman, A., Culberson, J., and Reddy, P.H. (2022). Phosphorylated Tau in Alzheimer's Disease and Other Tauopathies. Int J Mol Sci 23. 10.3390/ijms232112841.
2.Cookson, M.R. (2009). alpha-Synuclein and neuronal cell death. Mol Neurodegener 4, 9. 10.1186/1750-1326-4-9.
3.Jan, A., Gonçalves, N.P., Vaegter, C.B., Jensen, P.H., and Ferreira, N. (2021). The Prion-Like Spreading of Alpha-Synuclein in Parkinson's Disease: Update on Models and Hypotheses. Int J Mol Sci 22. 10.3390/ijms22158338.
4.Kaufman, S.K., Sanders, D.W., Thomas, T.L., Ruchinskas, A.J., Vaquer-Alicea, J., Sharma, A.M., Miller, T.M., and Diamond, M.I. (2016). Tau Prion Strains Dictate Patterns of Cell Pathology, Progression Rate, and Regional Vulnerability In Vivo. Neuron 92, 796-812. 10.1016/j.neuron.2016.09.055.
5.Sanders, D.W., Kaufman, S.K., DeVos, S.L., Sharma, A.M., Mirbaha, H., Li, A., Barker, S.J., Foley, A.C., Thorpe, J.R., Serpell, L.C., et al. (2014). Distinct tau prion strains propagate in cells and mice and define different tauopathies. Neuron 82, 1271-1288. 10.1016/j.neuron.2014.04.047.
6.Peng, C., Wei, W., Zhang, H., Wang, Y., Chang, B., Zhao, W., Jia, L., Li, L., Lu, F., and Liu, F. (2024). Heterologous expression and fibrillary characterization of the microtubule-binding domain of tau associated with tauopathies. Molecular Biology Reports 51, 184. 10.1007/s11033-024-09231-z.
7.Bachmann, S., Bell, M., Klimek, J., and Zempel, H. (2021). Differential Effects of the Six Human TAU Isoforms: Somatic Retention of 2N-TAU and Increased Microtubule Number Induced by 4R-TAU. Front Neurosci 15, 643115. 10.3389/fnins.2021.643115.
8.Elbaum-Garfinkle, S., Cobb, G., Compton, J.T., Li, X.-H., and Rhoades, E. (2014). Tau mutants bind tubulin heterodimers with enhanced affinity. Proceedings of the National Academy of Sciences 111, 6311-6316. doi:10.1073/pnas.1315983111.
9.Röntgen, A., Toprakcioglu, Z., Tomkins, J.E., and Vendruscolo, M. (2024). Modulation of α-synuclein in vitro aggregation kinetics by its alternative splice isoforms. Proc Natl Acad Sci U S A 121, e2313465121. 10.1073/pnas.2313465121.
10.Polymeropoulos, M.H., Lavedan, C., Leroy, E., Ide, S.E., Dehejia, A., Dutra, A., Pike, B., Root, H., Rubenstein, J., Boyer, R., et al. (1997). Mutation in the alpha-synuclein gene identified in families with Parkinson's disease. Science 276, 2045-2047. 10.1126/science.276.5321.2045.



























 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!


























 膜杰作
膜杰作 Star Staining
Star Staining