在ADC药物开发中,Linker的结构会影响ADC的稳定性、同质性、细胞毒性效力、耐受性和药代动力学 (PK)等。因此,选择合适的Linker对于优化ADC的治疗潜力和安全性至关重要。理想的Linker应该在循环系统中稳定并特异性地释放细胞毒性载荷到肿瘤部位,Linker的不稳定性往往会导致Payload在非肿瘤组织中的非特异性释放,产生脱靶毒性和有限的治疗窗口,限制ADC开发。因此,为了追求ADC的最佳治疗窗口,需要不断发现和发展新型Linker。
根据目前的研究,Linker一般分为可裂解Linker和不可裂解Linker。可裂解的Linker,可以有效裂解以释放肿瘤中的细胞毒性有效负载。超过80%的临床批准ADC采用可裂解Linker。可裂解Linker目前分为蛋白酶了裂解Linker、酸可裂解Linker、GSH可裂解linker、Fe(II)可裂解Linker以及新型酶可裂解Linker。在可裂解Linker中,其中二肽Linker是ADC中使用最经典的Linker,已在多种ADC中应用,可以被组织蛋白酶裂解。这篇文章主要对酶可裂解Linker中涉及到的酶进行梳理。
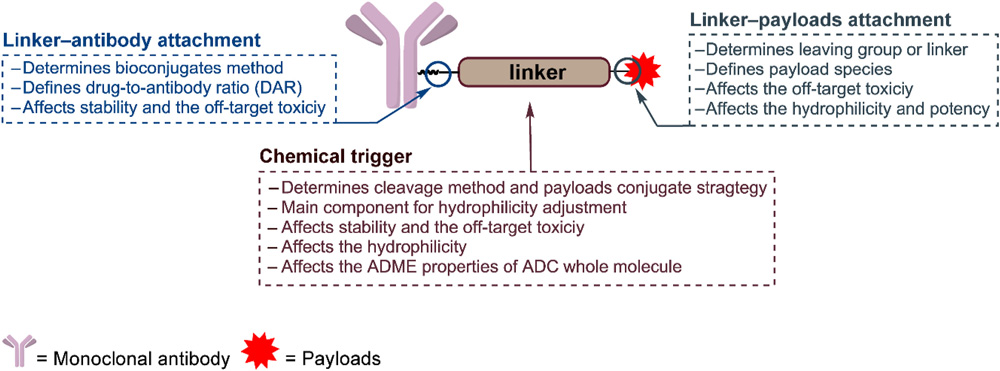
ADC的一般结构几个关键部分的作用
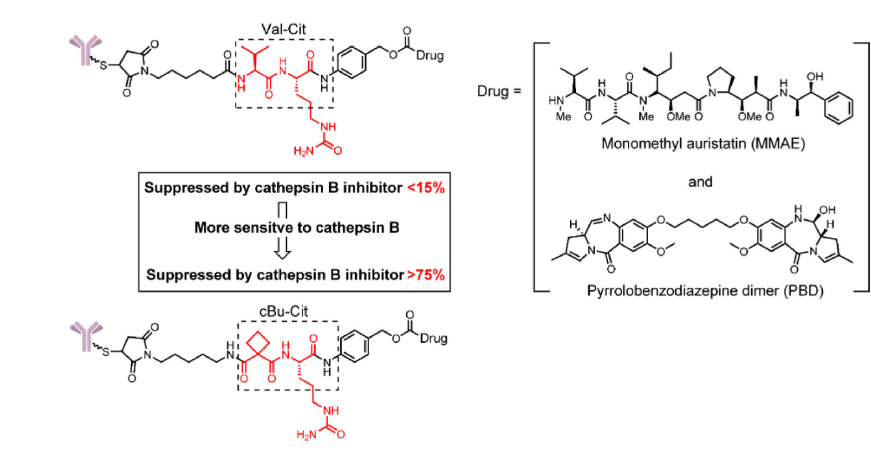
Caculitan等发现缬氨酸-瓜氨酸(Val-Cit)Linker对多种组织蛋白酶(Cathepsins)具有广泛的敏感性,包括Cathepsin B、K和L等。但是只有Cathepsin B在癌细胞中广泛表达,其对其他组织蛋白酶的广泛敏感性可能导致ADC在正常细胞中的脱靶毒性。
Wei等人设计了一种可以被Cathepsin B裂解的使用环丁烷-1,1-二羧酰胺(cBu)结构的Linker。在细胞内裂解研究中,cBu-Cit含有Linker的药物释放在75%以上被Cathepsin B抑制剂有效抑制,而Cathepsin K抑制剂没有显著影响。与传统的Val-Cit Linker相比,cBu-Cit Linker表现出更显著的抑制肿瘤生长效果。
研究表明,对肽Linker进行优化时,即使进行最小的结构改变也能显著影响其性能。研究人员开发了缬氨酸-丙氨酸(Val-Ala)Linker,实验证明Val-Ala比Val-Cit具有更好的亲水性和稳定性 。此外,研究显示,含有(l,l)二肽Linker 的ADC在体外和体内的抗肿瘤活性方面表现更优。
含有 cBu-Cit-PABC 的 ADC 的结构
基质金属蛋白酶2(MMP-2)在大多数肿瘤组织(如乳腺癌、宫颈癌和卵巢癌等)中高表达。研究表明,MMP-2可能促进癌细胞转移,调节其生长信号通路并抑制肿瘤凋亡。此外,在肿瘤微环境中,MMP-2能够降解外源性基质成分,有助于促进肿瘤侵袭以及转移,MMP-2的这些特性已被用于设计一系列不同的酶反应药物递送系统。与正常细胞不同的是,由于肿瘤微环境中的缺氧和弱酸性,使其成为癌症诊断和治疗中可控且高效的药物输送系统的有用生物触发器。
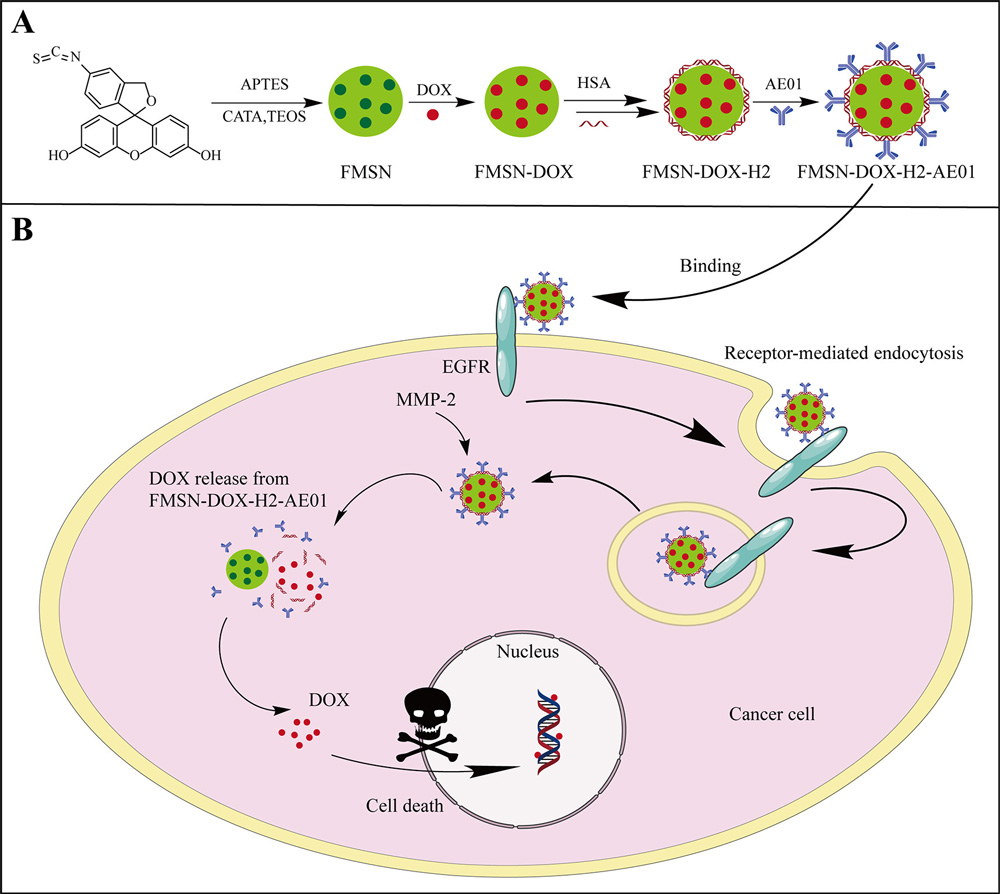
Wu等开发了一种新型抗体药物偶联物FMSN-Dox-H2-AE01,该药物偶联物基于人血清白蛋白(HSA)包覆的介孔硅纳米粒子(FMSN),通过将药物DOX嵌入到具有生物相容性的介孔二氧化硅纳米载体中,并结合抗EGFR抗体(AE01)以实现肿瘤靶向,利用肿瘤组织中高表达的MMP-2来触发药物释放,实现了对癌细胞的选择性杀伤。体外实验显示,该新型偶联药物可对癌细胞进行高效杀伤,而对正常细胞影响较小。此外,还能够根据不同的MMP-2水平和pH实现可控的药物释放效率。因此,该抗体与HSA多层纳米粒子有望成为一种有前景的酶响应型ADC以用于肿瘤治疗。
(A) AE01和HSA功能化的介孔二氧化硅纳米颗粒示意图。(B) FMSN-DOX-H2-AE01作用机制。
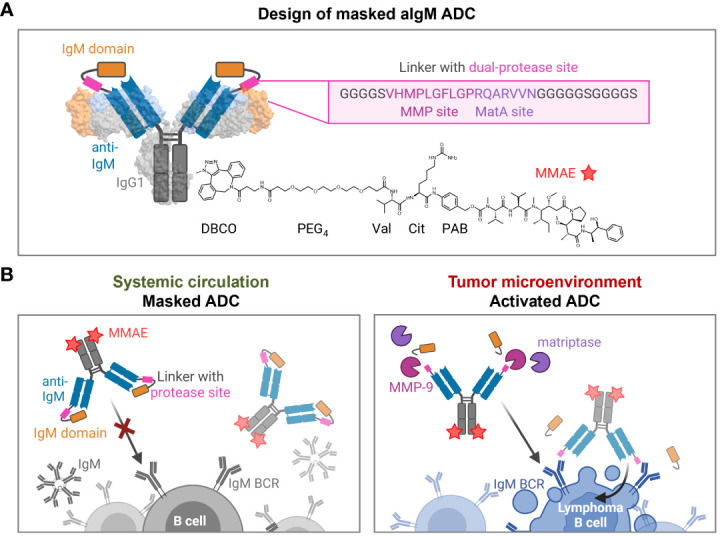
Katrin等开发了一种新型条件激活的抗IgM抗体药物偶联物(ADC),用于治疗IgM阳性B细胞淋巴瘤。该ADC以使用鸡源抗IgM抗体作为基础,并通过将人IgM域与轻链融合来实现遮蔽,防止其在循环中与可溶性IgM分子结合,减少非特异性毒性。之后偶联MMAE制备ADC。在肿瘤微环境中,肿瘤特异性蛋白酶如MMP-9和matriptase切割掩盖域,激活ADC,使其能够特异性结合肿瘤细胞并诱导凋亡。实验结果表明,该掩盖的ADC在IgM阳性B细胞上的结合能力显著降低,而经蛋白酶处理后恢复结合能力,展现出对IgM阳性B细胞的有效杀伤作用,而对IgM阴性细胞无影响。这些发现为开发更有效、更安全的B细胞淋巴瘤治疗方法提供了新的思路。
掩蔽 aIgM ADC 的设计和作用机制
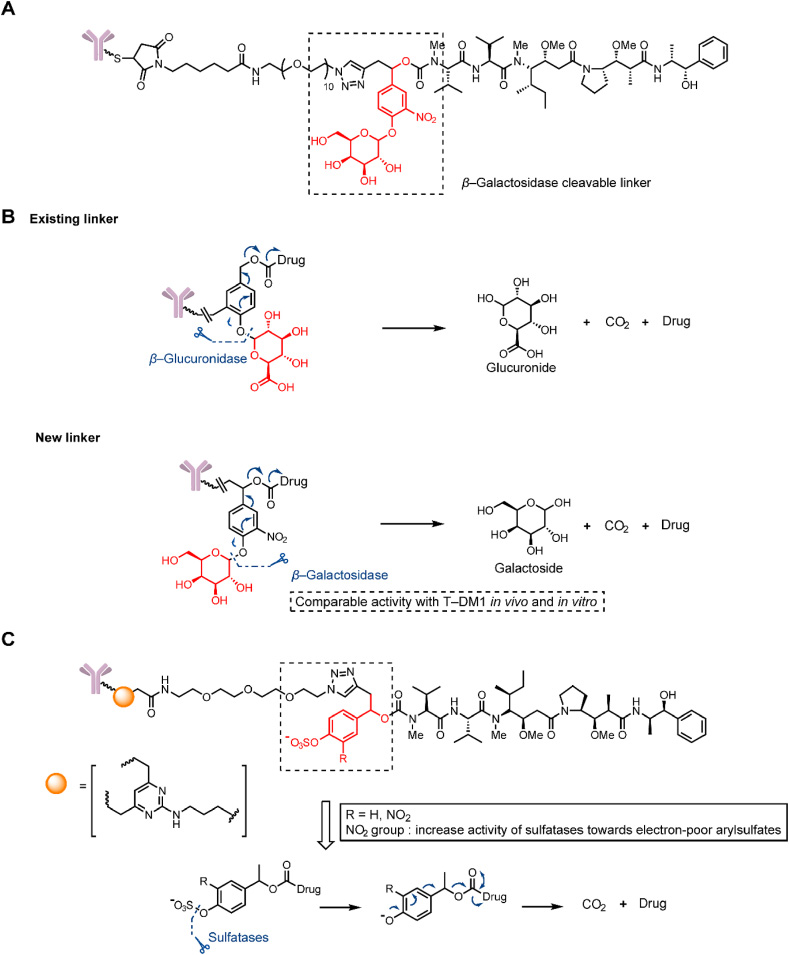
除了经典β-葡萄糖苷酶(β-glucuronidase)可裂解Linker外,发现肿瘤细胞中过表达的β-半乳糖苷酶(β-galactosidase)具有水解活性。Kolodych等人的研究描述了一种含有β-galactosidase可裂解Linker的ADC,这种Linker可在体外快速水解。通过这种Linker连接的ADC在体外表现出比传统Linker更低的IC50值,显示出更高的抗肿瘤活性。在体内实验中,使用这种Linker的ADC表现出显著减少肿瘤体积的能力,远远优于传统药物Kadcyla。此外,通过主成分分析,这些新型ADC显示出比Kadcyla更好的抑制肿瘤生长的效果。这些结果为利用β-半乳糖苷酶可裂解Linker设计更有效的ADC提供了有益的信息,有望推动肿瘤治疗的进步。
Bargh等人描述了一种由磺酶可裂解的Linker。磺酶类似于β-半乳糖苷酶,是肿瘤细胞中过度表达的水解酶。在释放研究中,磺酶可裂解Linker对磺酶酶具有明显的敏感性(半衰期=24分钟)。在小鼠血浆中,与1小时内水解的Val-Ala和Val-CitLinker结合物相比,磺酶可裂解Linker结合物表现出高血浆稳定性(超过7天)。与非可裂解ADCs的体外细胞毒性(IC50=609 pmol/L)和含有Val-Ala的ADCs(IC50=92 pmol/L)相比,含有磺酶可裂解Linker的ADCs表现出更高的细胞毒性以及在HER2+细胞中更优越的选择性。
糖苷酶和硫酸酯酶可裂解Linker的结构。(A) β-葡萄糖醛酸酶可裂解、含有Linker的ADC的结构。(B) β-葡萄糖醛酸酶和含有β-葡萄糖醛酸酶可裂解接头的ADC的释放机制。(C)含有硫酸酯酶可裂解Linker的 ADC 的结构和释放机制
|
测定产品
|
货号:CTB-H5222
Human Cathepsin B / CTSB Protein, His Tag (active enzyme)
|
|
水解底物
|
荧光标记多肽底物 Z-LR-AMC
|
|
酶活
(pmol/min/μg)
|
> 2500
|
|
测定产品
|
货号:MM9-H5221
Human MMP-9 Protein, His Tag (active enzyme)
|
|
水解底物
|
荧光标记多肽底物 Mca-PLGL-Dpa-AR-NH2
|
|
酶活
(pmol/min/μg)
|
> 2500
|
高效的抗体内吞作用对于抗体偶联药物(ADC)的效果至关重要。筛选出高亲和力的内化抗体对于确保药物的安全性和靶向性具有重要意义。
为了更好地满足ADC药物研发的需求,提供更高品质的内吞检测用试剂,邀请您花费几分钟时间参与此次关于ADC内吞检测试剂的专项调研,分享您宝贵的见解与建议,您将有机会获得一份精选礼品!
参考文献:
1.Antibody–drug conjugates: Recent advances in linker chemistry
2.Constructed Tumor-Targeted and MMP-2 Biocleavable Antibody Conjugated Silica Nanoparticles for Efficient Cancer Therapy
3.Conditional activation of an anti-IgM antibody-drug conjugate for precise B cell lymphoma targeting



















 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!


































 膜杰作
膜杰作 Star Staining
Star Staining