Tau蛋白是一种微管相关蛋白,广泛分布于中枢神经系统中,负责维持和调节神经元的形态和功能。在神经退行性疾病中,Tau蛋白异常聚集并形成神经原纤维缠结,破坏神经元的结构和功能,导致神经元死亡,进而推动疾病的进展。研究Tau蛋白在神经退行性疾病中的作用及其异常聚集的机制,对于开发新的诊断方法和治疗策略具有重要的意义。
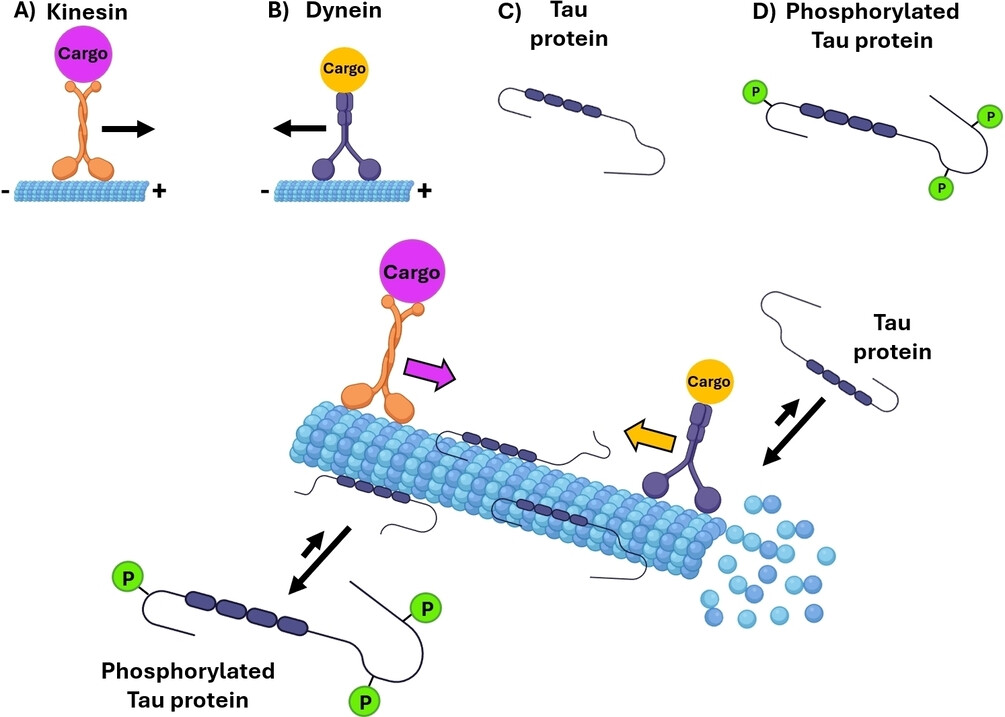
神经元是形态复杂的细胞,其功能和结构依赖于细胞骨架的动态重组。细胞骨架由微丝、微管和中间丝组成,微丝主要抵抗张力,微管负责维持细胞形态并参与物质运输,而中间丝则起到固定细胞器位置的作用。Tau蛋白是神经元中重要的微管相关蛋白,主要在轴突中与微管结合,促进微管的组装并防止其解聚,从而增强微管的稳定性。因此,Tau蛋白对维持细胞形态和支持物质运输至关重要。Tau蛋白的功能受到多种翻译后修饰的精细调控,其中磷酸化修饰会降低Tau蛋白与微管的亲和力,调节微管的动态平衡。这种机制对健康神经元的正常功能不可或缺。
https://doi.org/10.1002/cmdc.202400180
Tau蛋白在微管稳定性和物质运输中的作用
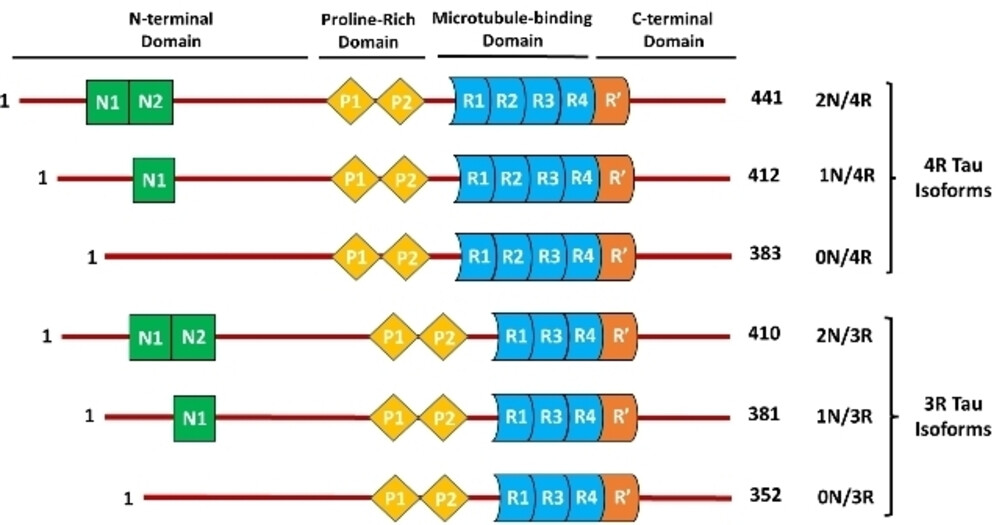
Tau蛋白由四个主要结构域组成:N端投射区、富脯氨酸区、微管结合区(MBD)和C端区。N端投射区与其他细胞骨架成分和细胞膜接触,在维持轴突的稳定中发挥重要的作用;富脯氨酸区含多个磷酸化位点,参与神经信号传递和细胞内信号转导的功能调控;MBD决定Tau蛋白与微管的结合能力;C端区域与MBD的功能相辅相成,共同维持微管的稳定性和功能。通过可变剪接,Tau蛋白可生成六种主要亚型,这些亚型的差异来源于N端插入序列(0N、1N、2N)和MBD重复序列(3R或4R)的不同。这些变异使得不同的Tau亚型在功能上表现出差异,特别是在微管结合能力方面。
https://doi.org/10.1002/cmdc.202400180
选择性剪接产生的六种Tau亚型
Tau蛋白在正常神经元功能中发挥着至关重要的作用,但其功能异常可能导致一系列神经退行性疾病的发生。
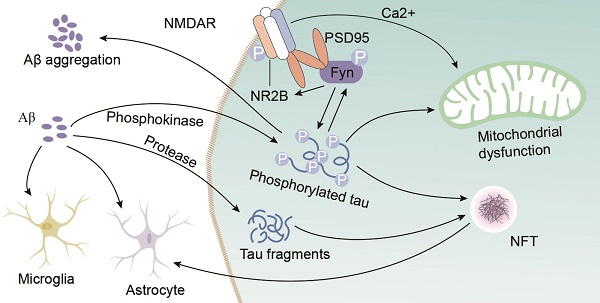
阿尔茨海默病(AD)是老年人中最常见和最复杂的神经退行性疾病,其重要的病理特征之一是Tau蛋白的异常磷酸化。Tau蛋白从微管上解离,形成无序的聚集体,最终形成神经纤维缠结,进而损害神经元的结构和功能,导致记忆丧失和认知障碍。β-淀粉样蛋白(Aβ)的积累是AD的另一个重要病理特征。研究表明,Tau的病理变化与Aβ的积累密切相关。在AD的早期阶段,Aβ会在神经元间积累并形成斑块,这些Aβ斑块通过激活炎症反应和诱导氧化应激,间接促进Tau的磷酸化和聚集。而Tau的聚集又可能加剧Aβ的毒性,形成恶性循环,推动AD的病理进展。
https://doi.org/10.7150/ijbs.57078
AD中Aβ和Tau的相互作用
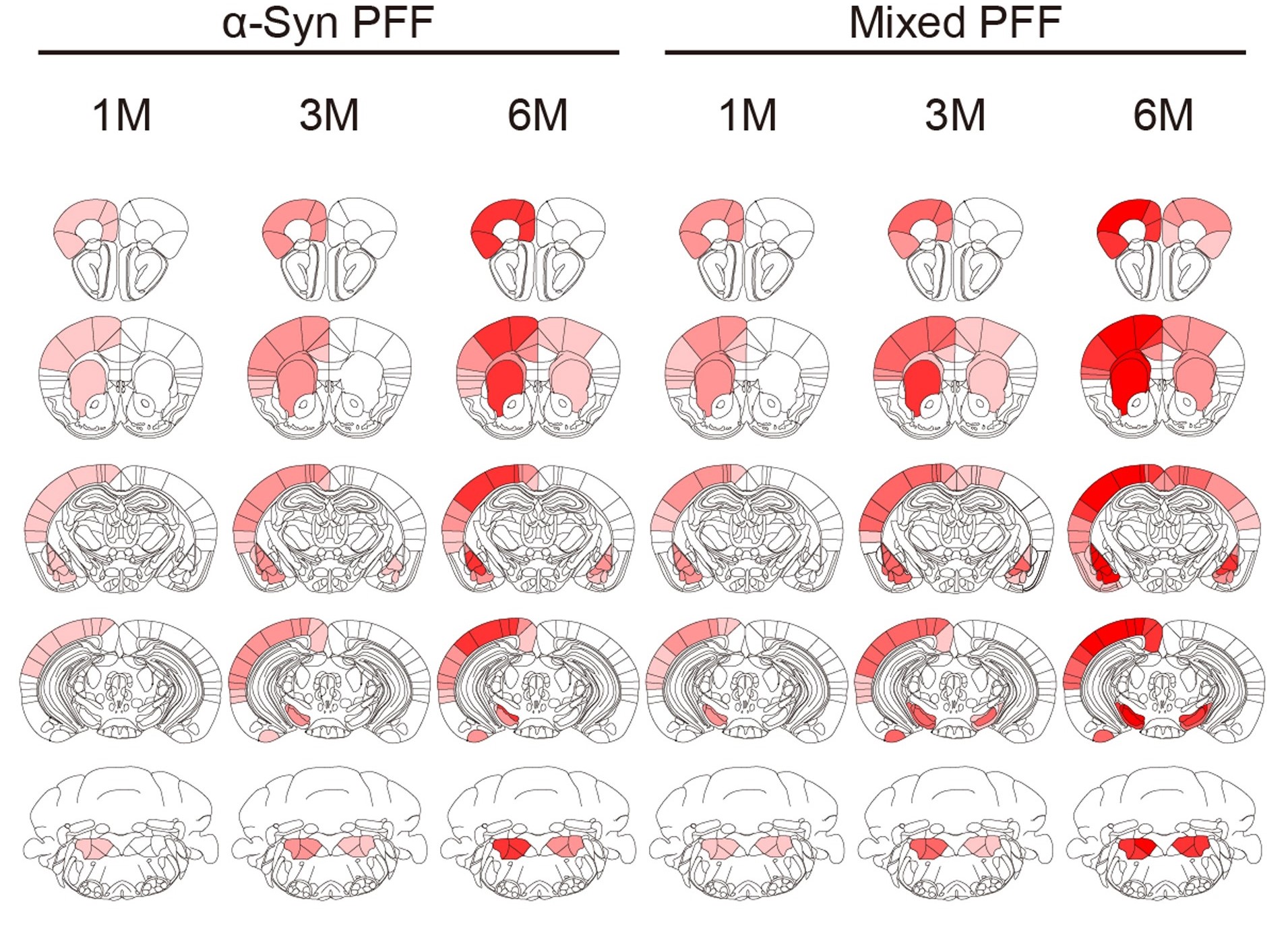
帕金森病(PD)是全球第二大常见的神经退行性疾病,其主要病理特征是α-突触核蛋白(α-syn)异常聚集形成路易小体,导致中脑黑质多巴胺能神经元的进行性丧失。越来越多的研究表明,Tau蛋白也参与了PD的病理进程。Pan L等人的研究发现,Tau蛋白能够与α-syn相互作用,并加速其聚集;混合Tau和α-syn的预制前体纤维(Pre-formed Fibrils, PFFs)比单独的α-syn PFFs具有更强的传播活性,并且能够引发线粒体和突触功能障碍以及神经毒性。此外,PD患者的尸检结果显示,Tau和α-syn共存于路易小体中。
https://doi.org/10.1093/brain/awac171
不同PFFs注射的小鼠大脑各区域pS129病理评分热图
pS129是α-syn蛋白上磷酸化的特定位点,通常作为α-syn病理聚集的标志物。热图显示了注射α-syn PFFs或混合Tau和α-syn PFFs的小鼠在不同脑区的α-syn病理分布和严重程度。颜色从白色到红色的变化表示病理聚集的增加,混合Tau和α-syn PFFs组的小鼠表现出更广泛且更严重的α-syn病理。
亨廷顿病(HD)是由亨廷顿基因(HTT)突变引起的神经退行性疾病,通常表现为运动障碍、认知缺陷和精神症状。尽管Tau磷酸化并不是HD的核心特征,但在HD的后期阶段,Tau的异常磷酸化和聚集在一些研究中被观察到,并可能与HD的病理变化相关。研究表明,突变的亨廷顿蛋白(mHtt)可能通过干扰Tau的调节机制,导致Tau的异常磷酸化和聚集。此外,HD患者的皮质和纹状体中Tau的4R/3R异构体比例升高,这表明Tau的错误剪接可能与HD的发生相关。这些发现表明Tau蛋白在HD病理中可能发挥重要作用。
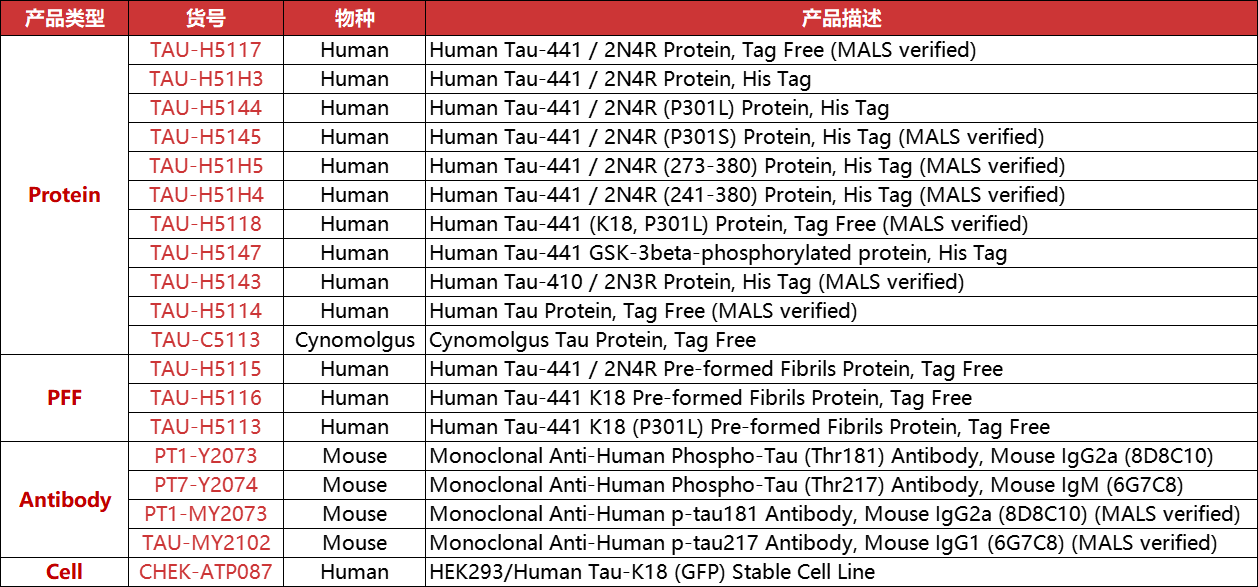
Tau蛋白在神经元的微管稳定性和细胞功能中至关重要,其异常聚集与AD、PD和HD等神经退行性疾病密切相关。为了支持对Tau蛋白机制的深入研究及相关疾病的探索,我们推出了一系列高质量的Tau产品,包括野生型、突变型及磷酸化的Tau蛋白、Tau PFFs、Tau稳定细胞株和p-tau抗体等,全面满足基础研究和药物筛选等多样化的需求。
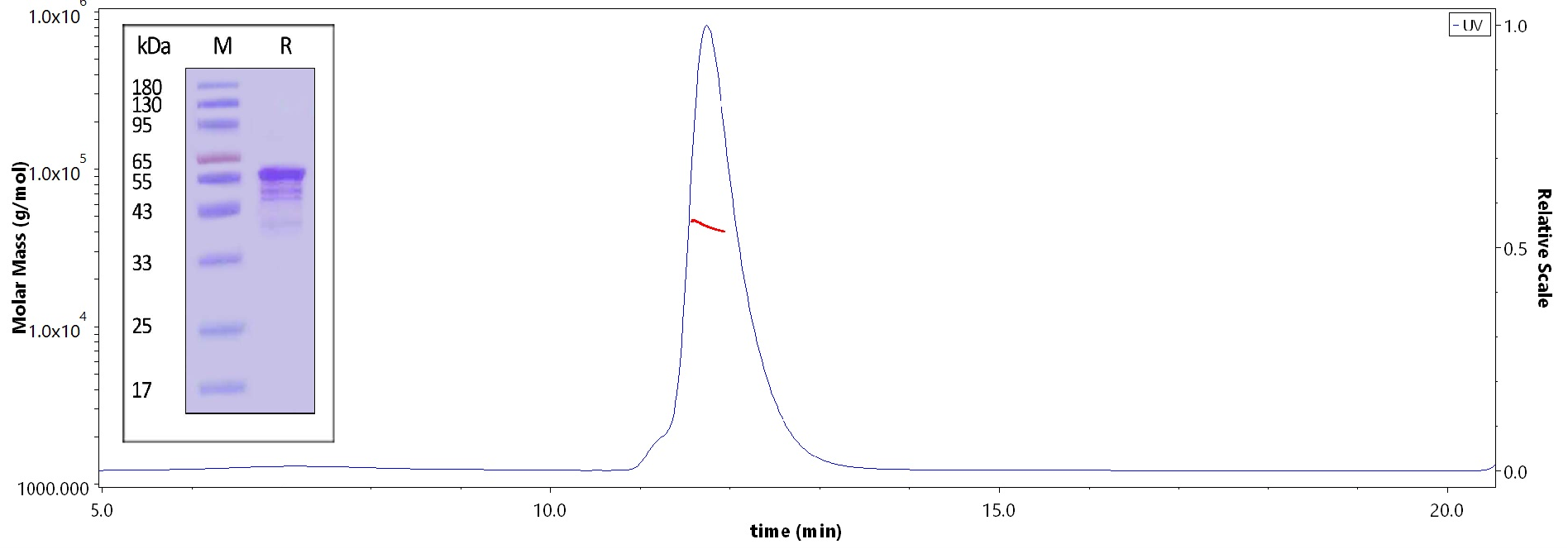
Human Tau-441, Tag Free (Cat. No. TAU-H5117) on SDS-PAGE under reducing (R) condition. The purity of the protein is greater than 90%. As verified by SEC-MALS, the purity is more than 90% and the molecular weight of this protein is around 38-55 kDa.
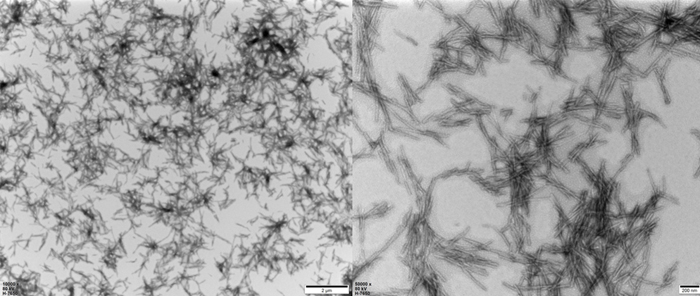
Transmission electron microscopy of Human Tau-441 K18 (P301L) Pre-formed Fibrils (Cat. No. TAU-H5113).
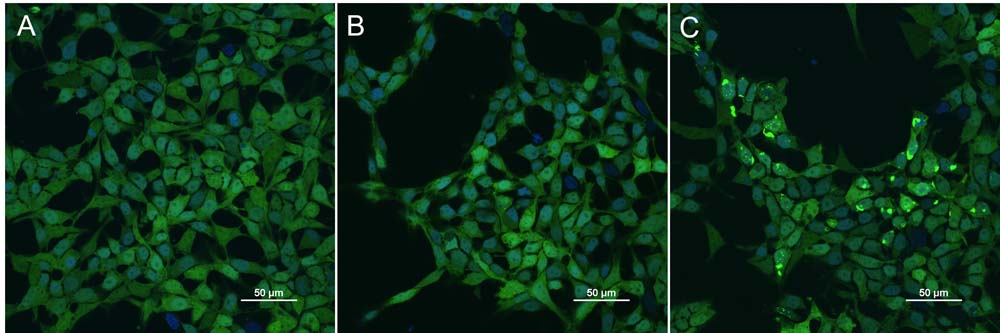
HEK293/Human Tau-K18 (GFP) Stable Cell Line (Cat. No. CHEK-ATP087) were transduced with Human Tau-441 Pre-formed Fibrils, Tag Free (Cat. No. TAU-H5115) and Human Tau-441, Tag Free (Cat. No. TAU-H5117) respectively. The fluorescence of GFP-Tau (Green) and DAPI (Blue) were detected by confocal microscope. A. Lipo2000 transduction. B. Lipo2000 and Human Tau-441, Tag Free transduction. C. Lipo2000 and Human Tau-441 Pre-formed Fibrils, Tag Free transduction. Scale bars, 50 μm (Routinely tested).
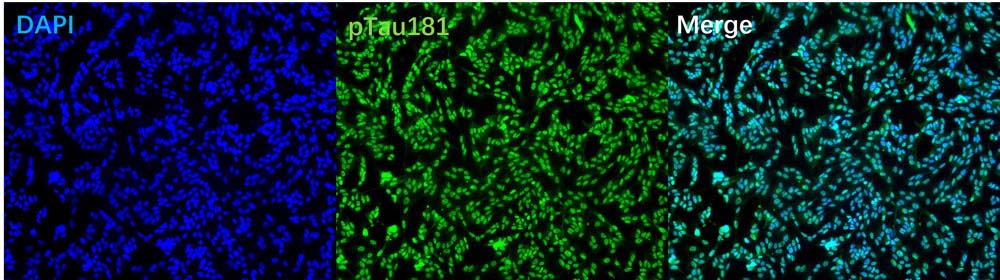
Immunofluorescent staining (10X) of phosphorylated tau in treated SH-SY5Y neuroblastoma cells with purified Monoclonal Anti-Human Phospho-Tau (Thr181) Antibody (Cat. No. PT1-Y2073) at 1:200 dilution. DAPI (blue) was used as nuclear counterstain.

>>点击图片,查看预制前体纤维
参考文献
1.Di Lorenzo D. Tau Protein and Tauopathies: Exploring Tau Protein–Protein and Microtubule Interactions, Cross‐Interactions and Therapeutic Strategies[J]. ChemMedChem, 2024, 19(21): e202400180. https://doi.org/10.1002/cmdc.202400180
2.Yang J, Zhi W, Wang L. Role of Tau Protein in Neurodegenerative Diseases and Development of Its Targeted Drugs: A Literature Review[J]. Molecules, 2024, 29(12): 2812. https://doi.org/10.3390/molecules29122812
3.Zhang H, Wei W, Zhao M, et al. Interaction between Aβ and tau in the pathogenesis of Alzheimer's disease[J]. International journal of biological sciences, 2021, 17(9): 2181. https://doi.org/10.7150/ijbs.57078
4.Pan L, Li C, Meng L, et al. Tau accelerates α-synuclein aggregation and spreading in Parkinson’s disease[J]. Brain, 2022, 145(10): 3454-3471. https://doi.org/10.1093/brain/awac171
5.Singh S, Khan S, Shahid M, et al. Targeting Tau in Alzheimer’s and Beyond: Insights into Pathology and Therapeutic Strategies[J]. Ageing Research Reviews, 2024: 102639. https://doi.org/10.1016/j.arr.2024.102639




















 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!

































 膜杰作
膜杰作 Star Staining
Star Staining