随着越来越多的细胞与基因疗法(CGT,Cell and Gene Therapy)不断获批上市,其日趋激烈的发展态势受到了国内外的高度关注,细胞和基因疗法进入了大放异彩的时代。与此同时,为满足基因与细胞治疗产品更深度的发展需求,一系列相关指导原则、政策法规等也相继颁布,提出了更高标准的药物规范要求,因此,在CGT领域快速发展的同时,其生产和商业化也面临着前所未有的挑战。
作为专注于生物药开发过程的蛋白技术、产品和服务的全球化品牌,ACROBiosystems百普赛斯有幸与您一起在细胞与基因治疗的发展浪潮中并肩前行。我们坚持为客户带来 “更特别的产品设计,更好更稳定的质量,更完备的技术帮助,更快更适当的反应”的核心价值,为细胞与基因治疗客户提供整体解决方案,为您提供一个更简便快速的药物开发过程,陪伴您从药物早期发现到临床研究的每一个阶段。
覆盖细胞和基因治疗开发的每个阶段
从早期研发到商业化
想要开发一款CAR细胞药物?
立即探索CAR-T细胞疗法的制造流程,了解每个阶段所需考虑的关键因素!
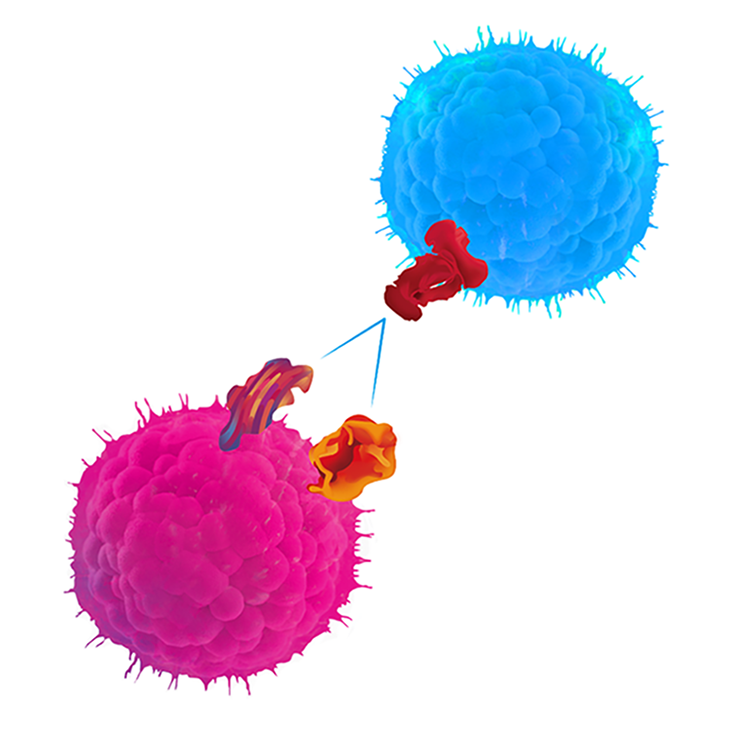
将修饰基因成功导入细胞是CAR细胞开发的重要步骤,您在开发CAR细胞疗法时,需要考虑以下主要因素。
CAR结构 - scFv、信号传导元件设计
载体 - 载体构建
起始原材料 - 细胞来源
CMC是细胞治疗药物生产过程中的关键阶段,需严格的生产、质控来确保产品质量。
载体生产&检测
起始细胞原材料
CAR细胞产品生命周期管理
CAR-T细胞生产
CAR-T质量控制

进入临床前研究是药物迈往商业化的一大步,在这一阶段,主要目的是验证细胞疗法在临床试验时的合理性和安全性。
载体/细胞的安全性 - 安全性和有效性
体内测试 - 小鼠或其他动物模型实验
附加修饰 - 其他功能性元件评估
临床研究是细胞疗法开发的最后一关,通常分为3个(或4个)阶段,以评估其在人体中的安全性和有效性。
受试人群/临床试验设计 - 目标人群、剂量探索研究
PK/PD研究 - 药物代谢、作用机制研究
免疫原性 - 受试者保护和临床安全性
安全性风险评估和临床监测

商业化!
立即探索CAR-T细胞疗法的制造流程,了解每个阶段所需考虑的关键因素!
将修饰基因成功导入细胞是CAR细胞开发的重要步骤,您在开发CAR细胞疗法时,需要考虑以下主要因素。
CAR结构 - scFv、信号传导原件设计
载体 - 载体构建
起始原材料 - 细胞来源
CMC是细胞治疗药物生产过程中的关键阶段,需严格的生产、质控来确保产品质量。
载体生产&检测
起始细胞原材料
CAR细胞产品生命周期管理
CAR-T细胞生产
CAR-T质量控制
进入临床前研究是药物迈往商业化的一大步,在这一阶段,主要目的是验证细胞疗法的在临床试验时的合理性和安全性。
载体/细胞的安全性 - 安全性和有效性
体内测试 - 小鼠或其他动物模型实验
附加修饰 - 其他功能性元件评估
04 临床研究:I期、Ⅱ期、Ⅲ期、V期
临床研究是细胞疗法开发的最后一关,通常分为3个(或4个)阶段,以评估其在人体中的安全性和有效性。
受试人群/临床试验设计 - 目标人群、剂量探索研究
PK/PD研究 - 药物代谢、作用机制研究
免疫原性 - 受试者保护和临床安全性
安全性风险评估和临床监测
一起探索多种细胞疗法
细胞疗法作为一种新型、革命性的治疗方式,可能在促进全球健康问题重大突破方面发挥重要作用。无论您是探索、开发、生产或商业化哪种类型的细胞疗法,我们都能提供种类丰富的产品,为您的细胞药物开发过程提供帮助,找到适合您的解决方案!
细胞疗法生产解决方案
GMP级别蛋白产品定制服务
具有“个性化”性质的细胞疗法,其开发过程使用的原材料也是个性化需求的,ACROBiosystems百普赛斯的GMP级别蛋白产品定制服务,可为您提供高品质GMP级别产品,满足个性化需求。
细胞生长因子
RUO、Premium、GMP级原料
细胞培养是细胞疗法生产制造过程中不可或缺的一部分,在药物研发到商业化的进程中,无论您有什么特殊需求,我们都能尽最大努力为您提供高质量、经过验证的细胞生长因子,保证您实验结果的一致性和稳定性。
建立真正的GMP级质量管理体系
对于细胞疗法而言,原材料的质量和安全性至关重要。为符合国内外法规,我们的质量管理体系实施了更加严格的质量控制和过程管理,以确保您使用的产品是安全的。
残留检测试剂盒
确保细胞疗法的安全性
细胞治疗是“活的”细胞产品,工艺过程引入的外源DNA或其他基因组存在巨大的产品质量和安全性风险。为确保您的细胞疗法符合法规要求,我们可提供核酸酶来清除DNA/RNA残留,此外,一系列高品质的残留检测试剂盒可满足您检测多种污染物。




















 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!

































 膜杰作
膜杰作 Star Staining
Star Staining